Os links do autor abrem o painel de sobreposiçãoPravat Kumar Parida 1 2Mauricio Marquez-Palencia 1 2 9Vidhya Nair 1 2 9Akash K. Kaushik 2 3Kangsan Kim 1 2Jessica Sudderth 3Eduardo Quesada-Diaz 1Ambar Cajigas 4Vamsidhara Vemireddy 2 5Paula I. Gonzalez-Ericsson 6Melinda E. Sanders 6Bret C. Mobley 6Kenneth Huffman 2Sunati Sahoo 1 2Prasanna Alluri 7Cheryl Lewis 2Yan Peng 1 2Robert M. Bachoo 2 5Carlos L. Arteaga 2 5Ariella B. Hanker 2 5Ralph J. DeBerardinis 2 3 8Srinivas Malladi 1 2 101Departamento de Patologia, University of Texas Southwestern Medical Center, Dallas, TX 75390, EUA2Harold C. Simmons Comprehensive Cancer Center, University of Texas Southwestern Medical Center, Dallas, TX 75390, EUA3Children’s Research Institute, University of Texas Southwestern Medical Center, Dallas, TX, EUA4Departamento de Neurociência, University of Texas Southwestern Medical Center, Dallas, TX 75390, EUA5Departamento de Medicina Interna, University of Texas Southwestern Medical Center, Dallas, TX 75390, EUA6Programa de Pesquisa do Câncer de Mama, Vanderbilt-Ingram Cancer Center, Vanderbilt University, Nashville, TN, EUA7Departamento de Oncologia de Radiação, University of Texas Southwestern Medical Center, Dallas, TX 75390, EUA8Howard Hughes Medical Institute, University of Texas Southwestern Medical Center, Dallas, TX, EUA
Resumo
Pacientes com câncer de mama HER2+ apresentam metástases cerebrais síncronas (S-BM), latentes (Lat) ou metacrônicas (M-BM) . No entanto, a base para a aptidão metastática díspar entre células tumorais disseminadas de oncotipo semelhante dentro de um órgão distal permanece desconhecida. Aqui, empregando modelos metastáticos cerebrais, mostramos que a diversidade metabólica e a plasticidade dentro das células trópicas cerebrais determinam a aptidão metastática. Lactato secretado por células metastáticas agressivas ou suplementação de lactato para camundongos portadores de células Lat limita a imunovigilância inatae desencadeia metástases evidentes. A atenuação do metabolismo do lactato no S-BM impede a metástase, enquanto o M-BM se adapta e sobrevive como doença residual. Em contraste com S-BM, Lat e M-BM sobrevivem em equilíbrio com a imunovigilância inata, oxidam a glutamina e mantêm a homeostase redox celular através do transportador de aminoácidos aniônico xCT. Além disso, a expressão de xCT é significativamente maior em amostras metastáticas cerebrais M-BM compatíveis em comparação com tumores primários de pacientes com câncer de mama HER2+. A inibição da função xCT atenua a doença residual e a recorrência nesses modelos pré-clínicos.
Resumo gráfico

alavras-chave
Introdução
As metástases cerebrais se desenvolvem após a disseminação de células do tumor primário para o cérebro através da vasculatura (Achrol et al., 2019). A maioria das células tumorais disseminadas (DTCs) no parênquima cerebral perece. Os poucos sobreviventes podem iniciar metástases síncronas que são detectadas junto com o tumor primário ou se adaptar e permanecer latente por meses a anos antes de desencadear um surto metastático metacrônico (Kienast et al., 2010;Kim et al., 2019;Massagué e Obenauf, 2016). As dependências de sobrevivência das células cancerosascom perfil genômico semelhante que se adaptaram diferencialmente ao parênquima cerebral são desconhecidos. Compreender essas diferenças é vital para elaborar estratégias eficazes que identifiquem e tratem pacientes com metástases metacrônicas síncronas ou tardias.
A incidência de metástase cerebral em pacientes com câncer de mama varia com o subtipo da doença. Pacientes com amplificação do receptor 2 do fator de crescimento epidérmico humano (HER2) ou com status de receptor hormonal triplo negativo (TN) têm maior risco de desenvolver metástases cerebrais do que aquelas com câncer de mama positivo para receptor de estrogênio e/ou receptor de progesterona positivo . Além disso, recaídas metastáticas no cérebro são comumente observadas em pacientes após terapia adjuvante primária ( Olson et al., 2013 ). Pacientes com câncer de mama HER2+ e metástases cerebrais sincrônicas, embora relativamente raras, têm uma sobrevida global média de cerca de 6 meses ( Ho et al., 2015). Metástases cerebrais metacrônicas são observadas em cinquenta por cento dos pacientes com câncer de mama HER2+ considerados livres de doença após um período de tempo variável pós-diagnóstico e tratamento primário ( Kabraji et al., 2018 ; Kodack et al., 2015 , 2017 ; Lin, 2015 ; Lin et al., 2017 ; Olson e Mullins, 2013 ; Olson et al., 2013 ). As terapias sistêmicas anti-HER2 são altamente eficazes para metástases extracranianas, mas ineficazes nas metástases cerebrais, apesar da entrega e atividade adequadas no parênquima cerebral ( Kabraji et al., 2018 ). Embora os inibidores de tirosina quinase permeáveis ao cérebro de pequenas moléculas(TKIs) são aprovados para o tratamento de pacientes com câncer de mama HER2+ com metástase intracraniana, o benefício de sobrevida global para o paciente é de curta duração ( Maher et al., 2009 ; Morikawa et al., 2015 ; Saleem et al., 2015 ).
Adaptações epigenéticas e metabólicas reversíveis provavelmente são responsáveis pela variabilidade observada na aptidão metastática de células tumorais disseminadas para órgãos distais ( Bergers e Fendt, 2021 ; Faubert et al., 2020 ; Li e Simon, 2020 ). Poucos estudos elegantes identificaram o papel do microambiente cerebral e a disponibilidade de nutrientes na formação do metabolismo e crescimento do DTC ( Ciminera et al., 2017 ). Neuregulinas expressas no microambiente cerebral promovem a sobrevivência de células tumorais no cérebro ( Kodack et al., 2017). A capacidade de utilizar acetato em adição à glicose como fonte de carbono é relatada para fornecer maior flexibilidade metabólica às células de câncer de mama, pulmão e pele, permitindo sua sobrevivência no microambiente cerebral ( Mashimo et al., 2014 ). Células de melanoma cerebral e câncer de mama TN podem aproveitar os ácidos graxos poliinsaturados liberados dos astrócitos para proliferar ( Jin et al., 2020 ; Zou et al., 2019 ). O aumento da dependência da fosforilação oxidativa também foi observado em tumores cerebrais e metástase cerebral de melanoma ( Chen et al., 2007 ; Fischer et al., 2019 ; Molina et al., 2018). As células de câncer de mama que imitam a expressão gênica neuronal e utilizam o ácido gama-aminobutírico para aumentar o ciclo do ácido cítrico análogo aos neurônios sobrevivem melhor no microambiente cerebral ( Neman et al., 2014 ). Células de câncer de mama TN metastático cerebral aumentam a gliconeogênese para sobreviver ( Chen et al., 2015 ) e têm expressão aumentada de enzimas glicolíticas ( Kim et al., 2014 ; Palmieri et al., 2009 ). Da mesma forma, serina e glicina microambientais limitadas resultam na seleção de células metastáticas cerebrais com maior dependência da síntese de novo de serina ( Ngo et al., 2020). As adaptações moleculares e metabólicas nos CDTs que resultam em apresentação de doença metastática cerebral síncrona, residual ou metacrônica ainda não foram definidas.
Através de uma triagem fenotípica em camundongos, isolamos células metastáticas cerebrais HER2+ síncronas (S-BM), residuais latentes (Lat) e metacrônicas (M-BM). Ao investigar essas células S-BM, Lat e M-BM fenotipicamente distintas do cérebro-trópico, descobrimos o impacto da diversidade metabólica e das adaptações na aptidão metastática e identificamos vulnerabilidades metabólicas nessas populações de células. A inibição genética ou farmacológica dessas vulnerabilidades limita as metástases cerebrais de câncer de mama HER2+ residuais e estabelecidas, identificando uma potencial oportunidade terapêutica.
Resultados
Seleção fenotípica de células metastáticas cerebrais de câncer de mama HER2+ sincrônicas, latentes e metacrônicas
Para isolar células metastáticas cerebrais isogénicas S-BM, Lat e M-BM HER2+, realizámos um rastreio fenotípico in vivo . Como fontes primárias de tumor, usamos células de adenocarcinoma de mama HER2+ – HCC1954, derivadas de um estágio primário IIA, carcinoma ductal invasivo grau 3 sem metástase linfonodal , e SKBR3 , derivadas de um derrame pleural em um paciente com doença metastática ( Tabela S1 ) . Células HCC1954 e SKBR3 transduzidas com GFP-luciferase e um vetor de resistência a antibióticos foram implantadas ortotopicamente em camundongos atímicos. A progressão do tumor e a incidência metastática foram monitoradas semanalmente por imagem bioluminescente (BLI). Observamos lesões S-BM evidentes em 2/10 camundongos portadores de tumores primários HCC1954 e nenhum em camundongos portadores de tumores SKBR3 5 semanas após a implantação. Geramos linhagens de células HCC1954 S-BM a partir dessas lesões metastáticas. Na maioria dos camundongos HCC1954 e SKBR3, apesar da progressão do tumor, os animais eram saudáveis sem metástases evidentes após 5 semanas. Imitando a prática clínica, ressecamos cirurgicamente o tumor primário e rastreamos camundongos quanto à incidência e progressão metastáticas. Metástases cerebrais M-BM atrasadas foram observadas aproximadamente 2 a 3 meses após a ressecção em camundongos implantados com HCC1954 (n = 3) e SKBR3 (n = 4). Geramos linhagens celulares HCC1954 e SKBR3 M-BM a partir dessas lesões metastáticas. Cérebros de ratos semO sinal BLI , aproximadamente 3 meses após a ressecção do tumor, foi dissociado em suspensões de células únicas; As células HCC1954 Lat (n = 4) e SKBR3 Lat (n = 3) foram recuperadas usando seleção de antibiótico ( Tabela S1 ).
Em seguida, avaliamos a estabilidade fenotípica dos derivados isogênicos isolados de HCC1954 (S-BM, Lat e M-BM) e SKBR3 (Lat e M-BM) injetando-os intracardialmente em camundongos atímicos. A incidência metastática precoce foi detectada em HCC1954 S-BM (~3 semanas) por BLI ( Figuras 1 A e 1B [painel esquerdo]). Camundongos portadores de células HCC1954 Lat eram predominantemente livres de metástase 2 meses após a injeção ( Figuras 1 A e 1B [painel do meio]), enquanto camundongos portadores de HCC1954 M-BM desenvolveram metástase dentro de 5-7 semanas após a injeção ( Figuras 1 A e 1B [painel direito]). Metástase para o cérebro foi predominante com metástase espinhal ocasionale muito raramente para outros órgãos distais. Doze semanas após a injeção, a maioria dos camundongos com células S-BM (14/15) e M-BM (10/14) sucumbiu à doença metastática cerebral HER2 , enquanto apenas 1/10 dos camundongos injetados com Lat desenvolveram metástase cerebral evidente ( Figuras 1A eS1A). No entanto, fomos capazes de detectar células Lat no cérebro desses camundongos sem ressonância magnética e sinal BLI (Figuras 1C [painel do meio] e1D). Observações semelhantes foram feitas com camundongos injetados com SKBR3 Lat e M-BM: camundongos injetados com M-BM desenvolveram metástases aproximadamente entre 7 e 8 semanas após a injeção, enquanto a maioria dos camundongos injetados com Lat (5/6) não desenvolveu metástase, mas tinha Lat residualcélulas cancerosas no cérebro ( Figuras S1 B e S1C). Análogo aos modelos metastáticos HCC1954, aproximadamente 75% dos camundongos portadores de células SKBR3 M-BM desenvolveram metástase cerebral 9 semanas após a injeção e sucumbiram à morte ( Figura S1 D). Selecionamos essas células metastáticas cerebrais isogênicas fenotipicamente estáveis de HCC1954 (S-BM, Lat e M-BM) e SKBR3 (Lat e M-BM) para análise posterior.
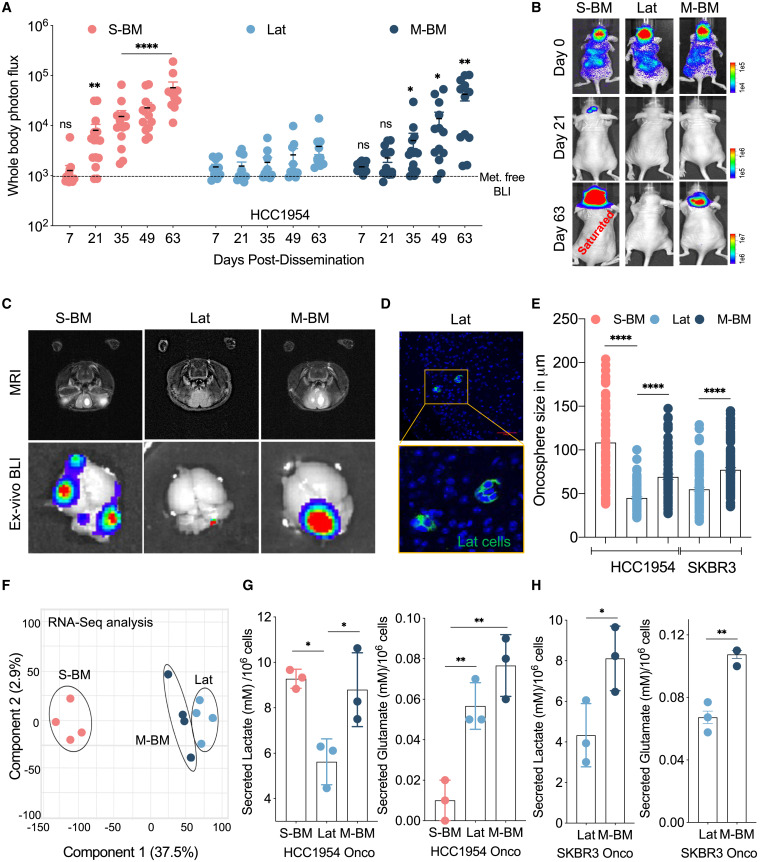
Células metastáticas cerebrais de câncer de mama HER2+ síncronas, latentes e metacrônicas são metabolicamente distintas
(A) Análise de imagem de
bioluminescência (BLI) mostrando o fluxo de fótons de corpo inteiro de camundongos com
injeção intracardíaca de células HCC1954 S-BM (painel esquerdo), Lat (painel do meio) e M-BM (painel direito).
Cada ponto representa um mouse individual. ∗ p < 0,05,
∗∗ p < 0,01,
∗∗∗ p < 0,001, e ns = não significativo: ANOVA de uma via.
(B) Imagens de BLI de camundongos inteiros nos dias 0, 21 e 63 mostrando diferentes
potenciais metastáticos cerebrais de S-BM (painel esquerdo), Lat (painel do meio) e M-BM (painel direito).
(C) Ressonância magnética (MRI), cérebro
ex vivo BLI de camundongos injetados com células S-BM, Lat e M-BM.
(D) A imagem de imunofluorescência (IF) mostra células metastáticas residuais latentes no cérebro sem sinal BLI.
(E) Gráfico de barras mostrando oncosfera quantificada por ImageJ
de células trópicas cerebrais indicadas de HCC1954 e SKBR3 . ∗∗∗∗ p < 0,0001, ANOVA de uma via.
(F) Análise de componentes principais (PCA) de genes diferencialmente expressos em células isogênicas do trópico cerebral.
(G e H) Nova Biomedical BioProfile 400 Analyzer (BioProfile 400) dados mostrando lactato e
glutamato secretados em HCC1954 (S-BM, Lat e M-BM) e SKBR3 (Lat e M-BM) em culturas de oncosfera.
(G) ANOVA de uma via e (H)
teste t de Student , ∗ p < 0,05,
∗∗ p < 0,01.
Metástases síncronas, latentes e metacrônicas são metabolicamente distintas
HCC1954 isogênico isolado e SKBR3 Lat e derivados metastáticos formam prontamente oncosferas tumorais 3D , um ensaio usado para medir a capacidade de iniciar tumor/metástase cultivando células tumorais em placas não adesivas sob condições livres de soro. Derivados lat formaram oncosferas de tamanho menor em comparação com S-BM e M-BM de HCC1954 e SKBR3 ( Figura 1 E). No entanto, nenhuma diferença significativa no número de oncosferas foi observada, implicando que todas elas tinham capacidade de iniciar metástases com potência variada de acordo com as diferenças fenotípicas observadas entre essas linhagens isogênicas. Além disso, na cultura 2D ou no implante ortotópico, não foi observada diferença significativa no crescimento entre as células S-BM, Lat e M-BM ( Figuras S1E-S1G). Da mesma forma, lesões metastáticas cerebrais em camundongos portadores de S-BM e M-BM não apresentaram diferenças significativas na coloração de Ki-67 ( Figura S1 H). A análise de componentes principais dos genes expressos diferencialmente, medidos por sequenciamento de RNA , destacou diferenças nos perfis transcriptômicos de derivados de HCC1954. Lat e M-BM agrupados longe de S-BM ( Figura 1 F). A análise de enriquecimento do conjunto de genes revelou enriquecimento para glicólise e metabolismo de ácidos graxos em S-BM e M-BM em comparação com células Lat ( Figuras S1 I e S1J).
Como perfis transcriptômicos e características fenotípicas sugeriram que Lat e derivados metastáticos (S-BM e M-BM) são metabolicamente distintos, estimamos sua capacidade de catabolizar glicose e glutamina, fontes proeminentes de bioenergética e biossíntese em células cancerígenas ( DeBerardinis e Cheng, 2010). ). O metabolismo da glicose em piruvato pode suportar o ciclo do ácido tricarboxílico (TCA) ou resultar na conversão em lactato. A glutamina é uma importante fonte de carbono e nitrogênio para uma variedade de vias que suportam a bioenergética, biossíntese e homeostase redox. Os níveis de lactato secretado foram significativamente maiores em derivados metastáticos agressivos de HCC1954 e SKBR3 (S-BM e M-BM) em comparação com células Lat em culturas de oncosfera 2D e 3D ( Figuras 1 G, 1H, S1 K e S1L).
A alta secreção de lactato também foi observada em derivados metastáticos cerebrais MMTV-HER2 singênicos em comparação com suas contrapartes parentais ( Valiente et al., 2014 ) ( Figura S1 M). Observações semelhantes foram feitas em células MMTV-HER2-PIK3CA H1047R invasivas e resistentes à terapia ( Hanker et al., 2013 ) ( Figura S1 N). Observamos um aumento significativo na secreção de glutamato em Lat e M-BM em comparação com S-BM em células HCC1954 ( Figuras 1 G e S1 K). Da mesma forma, a secreção de glutamato também foi alta em HCC1954 e SKBR3 M-BM em comparação com Lat ( Figuras 1 G, 1H, S1K e S1L). Além disso, o glutamato secretado foi significativamente maior em um dos derivados metastáticos cerebrais de MMTV-HER2 em comparação com células MMTV-HER2 primárias e em células MMTV-HER2-PIK3CA H1047R ( Figuras S1 M e S1N).
Padrões distintos de utilização de glutamina em células de câncer de mama metastático cerebral disseminado
Em seguida, para avaliar os padrões de utilização de glicose e glutamina e sua contribuição para as diferenças observadas nos pools de metabólitos , realizamos análises de rastreamento de isótopos de 13 C 6 glicose e 13 C 5 glutamina em BLI + lesões metastáticas cerebrais com intensidades de sinal semelhantes em camundongos injetados com HCC1954 S -BM e M-BM ( Figura 2 A). Camundongos portadores de lesões BLI + M-BM e S-BM foram anestesiados e infundidos por via intravenosa com um bolus de 13 C 6 glicose ou 13 C 5glutamina, seguida de infusão contínua por 3 ou 5 h, respectivamente, para atingir níveis séricos estáveis ( Faubert et al., 2017 ; Marin-Valencia et al., 2012 ). Em seguida, realizamos imagens de BLI e identificamos lesões metastáticas por imagens ex vivo , que coletamos para análise de metabólitos. A marcação dos intermediários do ciclo do TCA a partir da glicose não foi significativamente diferente entre as lesões M-BM (n = 6) e S-BM (n = 6) ( Figura S2 A). Um aumento acentuado na marcação dos intermediários do ciclo do TCA succinato (M+4), malato (M+4), aspartato (M+4) e citrato (M+4) da glutamina foi observado em M-BM (n = 6 ) em comparação com S-BM (n = 6) lesões cerebrais (Figura 2B). A carboxilação redutiva foi proeminente nas metástases cerebrais de S-BM com uma razão de citrato significativamente alta (M+5/M+4) em lesões de S-BM ( Figura 2 C).
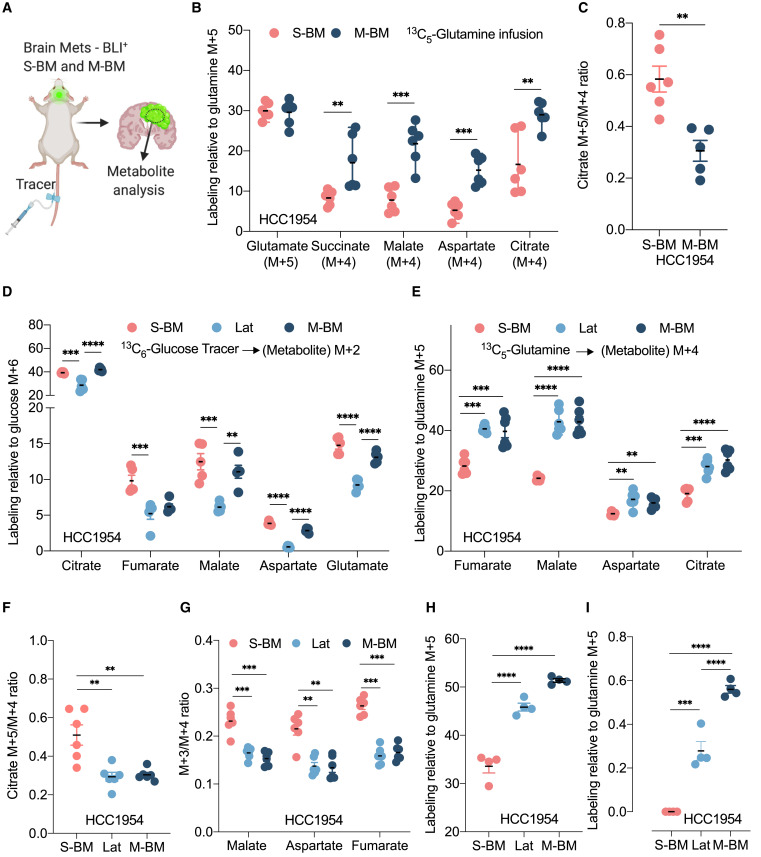
Padrões distintos de utilização de glutamina em células de câncer
de mama fenotipicamente distintas
(A) Desenho mostrando o processo de rastreamento
in vivo de isótopos de glicose
13 C
6 e glutamina
13 C
5 em lesões metastáticas cerebrais positivas para BLI.
(B) Marcação total de metabólitos indicados em lesões metastáticas cerebrais analisadas por espectrometria de massa e normalizadas para
13C
5 -glutamina enriquecida
.
∗∗ p < 0,01,
∗∗∗ p < 0,001,
teste t de Student .
(C) Razões citrato M+5/M+4 destacando carboxilação redutiva
de glutamina em S-BM e carboxilação oxidativa em M-BM. ∗∗ p < 0,01, teste t de Student.
(D)
O traçado
de
13C6 -glicose em células isogênicas HCC1954 trópicas ao cérebro mostra a contribuição diferencial da glicose para os metabólitos do ciclo TCA .
(E) Rastreamento de
13 C
5 -glutamina em células isogênicas HCC1954 trópicas ao cérebro, destacando o enriquecimento diferencial de metabólitos em células S-BM, Lat e M-BM.
(F e G) razão M+5/M+4 (citrato) e M+3/M+4 (malato,
aspartato e fumarato) indicando carboxilação redutiva enriquecida de glutamina em S-BM e carboxilação oxidativa de glutamina em Lat e M-BM.
(H e I) Gráfico representativo mostrando o enriquecimento de M+5-glutamato e M+3 lactato em meio sobrenadante de S-BM, Lat e M-BM.
(D–I) Estatística:
∗∗ p < 0,01,
∗∗∗ p < 0,001,
∗∗∗∗ p < 0,0001: ANOVA de uma via seguida pelo teste de Dunnett.
Como os camundongos portadores de células Lat são negativos para BLI, identificar e isolar células Lat para análise metabólica rápida apresentou desafios técnicos. Portanto, recorremos a experimentos de rastreamento in vitro usando derivados metastáticos e Lat. Realizamos dois experimentos de marcação complementar cultivando células trópicas cerebrais com 13 C 6 glicose e glutamina não marcada e glicose não marcada com 13 C 5 glutamina. Os metabólitos foram extraídos após 8 h e analisados por cromatografia gasosa-espectrometria de massa para obter distribuições isotopólogas de massa de intermediários do ciclo TCA. Derivados metastáticos (M-BM e S-BM) mostraram aumento da contribuição da glicose para os intermediários do ciclo do TCA citrato, fumarato, malato, aspartato e glutamato em comparação com derivados Lat ( Figura 2 D). Em contraste, o rastreamento de glutamina revelou semelhanças entre HCC1954 Lat e M-BM que eram distintas de S-BM ( Figuras 2 E e S2 B). Fumarato (M+4), malato (M+4), aspartato (M+4) e citrato (M+4) aumentados foram observados em HCC1954 Lat e M-BM sugestivos de metabolismo oxidativo , enquanto as células S-BM exibiram aumentos relativos nos conjuntos de citrato (M+5/M+4), malato (M+3/M+4), aspartato (M+3/M+4) e fumarato (M+3/M+4), sugerindo carboxilação redutiva aumentada ( Figuras 2 E-2G) de acordo com nossos achados in vivo . Observações análogas foram feitas nos sistemas de modelo SKBR3 Lat e M-BM (Figuras S2C e S2D). Além disso, níveis aumentados de glutamato 13C5 secretado foram observados em derivados HCC1954 Lat e M-BM de acordo com os resultados obtidos do Nova Biomedical BioProfile 400 Analyzer ( Figura 2 H).
Um enriquecimento significativamente maior de M+3 lactato a partir de 13C5 glutamina foi observado em células HCC1954 M-BM e Lat em comparação com S-BM ( Figura 2 I). Comparando as células Lat e M-BM de HCC1954 e SKBR3, o enriquecimento de M+3 lactato foi significativamente maior em células M-BM ( Figuras 2 I e S2E ). A enzima málica (ME), que conduz a descarboxilação oxidativa reversível do malato em piruvato, poderia contribuir para o aumento observado no lactato secretado pelas células M-BM ( DeBerardinis et al., 2007 ). De fato, a análise de Western blot mostrou expressão aumentada de ME em M-BM em relação a Lat ( Figura S2 F).A pequena depleção de RNA interferente de ME em M-BM resultou em uma diminuição significativa no lactato secretado em células M-BM ( Figuras S2G e S2H; Tabela S2 ). Tomados em conjunto, esses dados destacam padrões diferenciais de utilização de glutamina em células de câncer de mama HER2+ residentes no cérebro disseminadas fenotipicamente distintas.
Suplementação de lactato desencadeia metástase evidente em camundongos com doença residual
O lactato extracelular pode ser reutilizado pelas células tumorais como fonte de combustível para sustentar o ciclo do ácido cítrico e/ou pode alterar a atividade das células estromais no microambiente cerebral , resultando em uma metástase estabelecida. A expressão do transportador de captação de lactato MCT1 foi baixa nas células S-BM, Lat e M-BM de trópicos cerebrais em comparação com as células HCC1954 parentais, enquanto a expressão do transportador de efluxo de lactato MCT4 não foi alterada. Para testar se o lactato exógeno é suficiente para promover metástase cerebral, administramos lactato, lactato de sódio ou PBS intraperitonialmente três vezes por semana a camundongos atímicos portadores de células HCC1954 Lat ( Figura 3UMA). A administração de lactato ou lactato de sódio deu origem a metástases cerebrais evidentes e conferiu sobrevida global pobre em relação aos controles ( Figuras 3 B, S3A e S3B ). Observações semelhantes foram feitas em camundongos atímicos portadores de células SKBR3 Lat ( Figuras 3 C e S3 C).
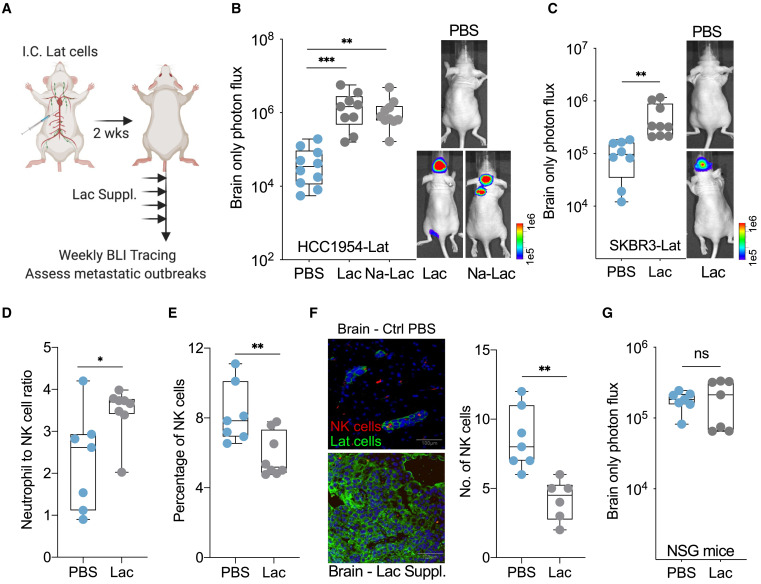
Suplementação de lactato desencadeia surto metastático em camundongos com doença residual
(A) Esquema ilustrando o desenho experimental.
As células HCC1954 ou
SKBR3 Lat foram injetadas intracardialmente.
Duas semanas após a injeção de lactato (Lac) ou
lactato de sódio (Na-Lac) foi administrado por via intraperitoneal (100 μL de 1 mM Lac ou Na-Lac).
A incidência metastática foi rastreada pelo BLI .
(B) Incidência metastática cerebral como medida do fluxo de fótons em camundongos portadores de células HCC1954 Lat administradas com PBS, Lac ou Na-Lac.
ANOVA de uma via:
∗∗ p < 0,01,
∗∗∗ p < 0,001.
(C) Fluxo de fótons apenas no cérebro mostrando carga metastática em camundongos com células SKBR3 Lat administradas com PBS ou Lac.
∗∗ p < 0,01:
Teste t de Student .
(D) Alterou a proporção de
neutrófilos para células NK após tratamento com lactato em camundongos portadores de células HCC1954 Lat.
(E) Análise de citometria de fluxo de sangue periférico mostrando células NK circulantes como uma porcentagem de células CD45+.
∗∗ p < 0,01: Teste t de Student.
(F) imagem imunofluorescente de seções de cérebro de camundongo destacando a diminuição do número de células NK (vermelho, NKp46) na proximidade de células HCC1954 Lat (verde, GFP) após o tratamento com lactato.
(G) Progressão metastática de células HCC1954 Lat em camundongos NOD.Cg-
Prkdc scid Il2rg tm1Wjl /SzJ (camundongos NOD/SCID Gamma [NSG]) após tratamento com PBS e lactato.
A análise do sangue coletado antes da eutanásia não revelou diferenças persistentes no estado de equilíbrio nos níveis séricos de lactato ( Figura S3 D). A análise de sangue periférico mostrou um aumento na proporção de neutrófilos circulantes para células natural killer (NK) em camundongos tratados sistemicamente com lactato ( Figura 3 D). Uma diminuição significativa nas células NK circulantes foi observada sem diferenças aparentes em neutrófilos e macrófagos ( Figuras 3 E e S3 E-S3G). Além disso, uma redução significativa no número de células NK foi observada em lesões metastáticas de camundongos suplementados com lactato em comparação com lesões micrometastáticas em camundongos injetados com PBS com células Lat ( Figura 3F). Análoga a essas observações, a depleção de células NK em camundongos atímicos portadores de células HCC1954 Lat ou injetar células Lat em camundongos NOD.Cg- Prkdc scid Il2rg tm1Wjl /SzJ (camundongos NOD/SCID Gamma [NSG]) que não possuem células NK funcionais resulta em surtos ( Er et al., 2018 ; Malladi et al., 2016 ; Shultz et al., 2005 ). Como a depleção de células NK de camundongos portadores de células Lat resultará em surtos metastáticos, independentemente do tratamento com lactato, avaliamos o impacto da administração de lactato em camundongos NSG portadores de células Lat e não encontramos diferença significativa no crescimento metastático após a suplementação de lactato ( Figuras 3 G e S3H). Tomadas em conjunto, essas observações sugerem que o lactato exógeno ajuda as células Lat a escapar da vigilância imune inata mediada por células NK .
O lactato limita o agrupamento de células NK e a citotoxicidade
Em seguida, avaliamos o impacto do lactato na atividade das células NK e sua capacidade de induzir a morte celular . Células NK humanas ativadas por interleucina-2 (IL-2) derivadas de células mononucleares do sangue periférico formam aglomerados, e esse priming é crítico para a citotoxicidade das células NK ( Harmon et al., 2019 ; Kim et al., 2017 ). O tamanho e o número de aglomerados de células NK foram significativamente reduzidos na presença de lactato ou do sobrenadante de derivados metastáticos e células Lat ( Figuras 4 A, 4B e S4 A). Redução significativa no tamanho do aglomerado de células NK também foi observada com células NK isoladas de baço de camundongo após exposição a lactato ou sobrenadante de células metastáticas ( Figura S4B). A secreção de moléculas efetoras necessárias para a morte de células-alvo – interferon gama (IFN – γ) e granzima-b – também foi significativamente reduzida na presença de lactato ou sobrenadante de células trópicas do cérebro ( Figuras 4 C, 4D, S4 C e S4D ). O sobrenadante dos derivados metastáticos do cérebro (S-BM e M-BM) diminuiu significativamente o agrupamento de células NK humanas e de camundongo e a resposta citotóxica em relação ao sobrenadante dos derivados Lat ( Figuras 4 A-4D e S4A-D ).
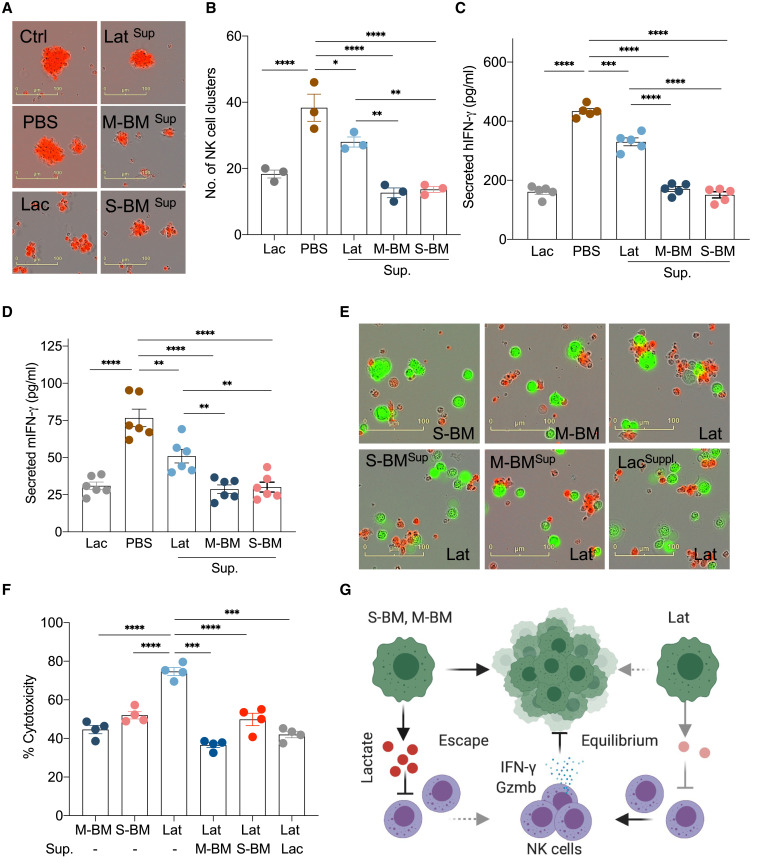
O lactato limita o agrupamento
de células NK e a citotoxicidade
(A) Imagens representativas de InCucyte destacando o efeito de lactato (10 mM) ou sobrenadante de mídia de S-BM, Lat e M-BM no agrupamento de células NK humanas.
(B) Gráfico mostrando a quantificação de aglomerados de células NK humanas sob condições indicadas.
(C) Níveis de IFN
– γ secretados por células NK humanas na presença de lactato ou sobrenadante de S-BM, Lat e M-BM.
O IFN-γ secretado por células tumorais de cada condição de meio foi subtraído para estimar o IFN-γ secretado por células NK.
ANOVA de uma via seguida pelo teste de Turkey.
(D) IFN-γ secretado de células NK de camundongos na presença de lactato ou sobrenadante de S-BM, Lat e M-BM.
(E e F) Imagens representativas e quantificação da citotoxicidade mediada por células NK após a suplementação de lactato ou sobrenadante de S-BM e M-BM para células Lat.
(G) Modelo esquemático destacando o papel do lactato na promoção da fuga da
vigilância imune inata em derivados metastáticos em comparação com as células Lat que sobrevivem em equilíbrio com a vigilância imune inata.
Ensaios de citotoxicidade in vitro foram realizados para avaliar a capacidade de Lat e derivados metastáticos de sobreviver na presença de células NK. Células NK ativadas com IL-2 recentemente isoladas de baços de camundongos e uma linha de células NK humanas foram incubadas com metastáticos isogênicos e derivados Lat. Em comparação com as células Lat, S-BM e M-BM foram resistentes à morte celular mediada por células NK ( Figuras 4 E, 4F, S4 E e S4F). A suplementação de lactato ou adição de sobrenadante de S-BM e M-BM a células Lat resultou em citotoxicidade reduzida de células NK e aumento da sobrevivência em comparação com o controle ( Figuras 4 E, 4F, S4E e S4F). Esses dados sugerem que, enquanto as células Lat sobrevivem em equilíbrio com a vigilância imunológica mediada por células NK, o lactato secretado pelas células metastáticas cerebrais limita a função das células NK e ajuda a escapar da vigilância imunológica inata ( Figura 4 G).
Efeito diferencial da limitação do metabolismo do lactato em S-BM e M-BM
Expressão aumentada de enzimas glicolíticas , lactato secretado e oxidação de glicose em derivados metastáticos ( Figuras 1 G, 1H, 2 D, S1 K, S1L, S2 C e S5 A) e a capacidade do lactato exógeno de limitar a citotoxicidade das células NK e estimular metástases evidentes em camundongos com doença residual ( Figuras 3 e 4 ) nos levaram a explorar o potencial terapêutico do oxamato de sódio , um análogo do piruvato que inibe a conversão de piruvato em lactato pela lactato desidrogenase .
O tratamento com oxamato de sódio, como previsto, reduziu a quantidade de lactato secretado em derivados metastáticos em comparação com as células Lat ( Figura 5 A). Da mesma forma, a administração de estiripentol que inibe a atividade da lactato desidrogenase (LDH) ( Sada et al., 2015 ) também resultou na redução da secreção de lactato em derivados metastáticos ( Figura S5 B). Em seguida, avaliamos o impacto do oxamato de sódio na incidência metastática em camundongos injetados com HCC1954 M-BM e S-BM por administração intraperitoneal. O oxamato de sódio foi bem tolerado e nenhuma diferença no peso corporal foi observada em relação aos controles ( Figura S5 C). Para nossa surpresa, uma redução significativa na incidência metastática foi observada apenas em S-BM (Figuras 5B e S5D ). Embora houvesse uma tendência de redução da incidência metastática, nenhuma diferença significativa foi observada em camundongos injetados com M-BM ( Figura S5 D).
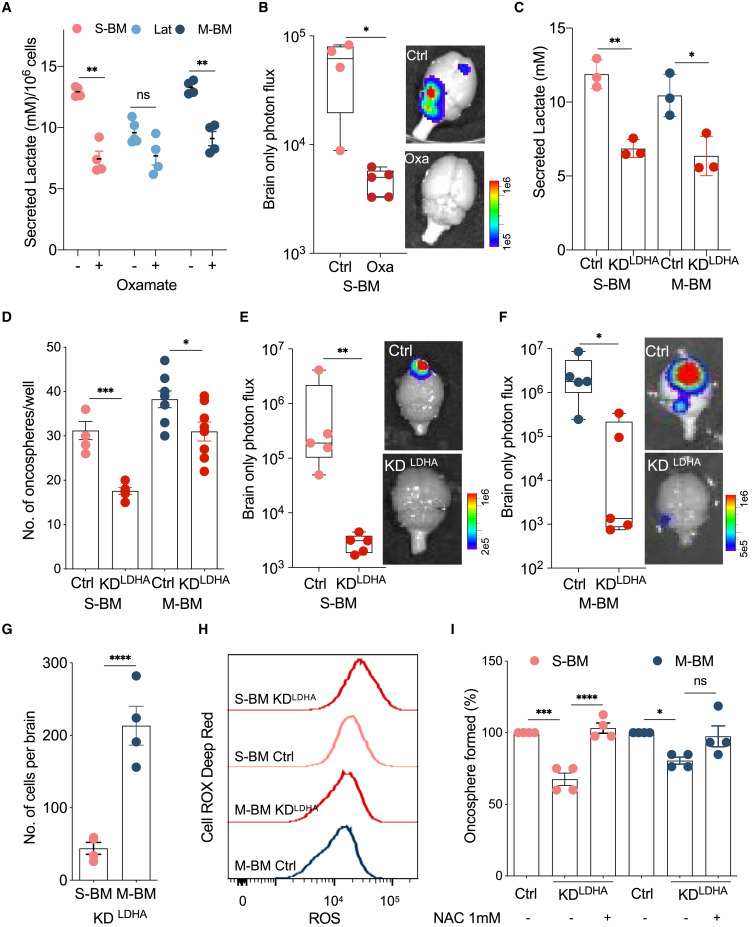
Efeito diferencial da limitação do metabolismo do lactato em S-BM e M-BM
(A) Efeito do
oxamato de sódio (10 mM) na secreção de lactato em células S-BM e M-BM com alto teor de LDHA e células Lat com baixo teor de LDHA.
(B) Crescimento metastático medido pelo fluxo de fótons apenas no cérebro em camundongos injetados com S-BM tratados com veículo ou oxamato de sódio (intraperitonealmente: 750 mg/kg de peso corporal).
(C) a depleção de LDHA mediada por shRNA
(KD LDHA ) atenua a secreção de lactato em derivados metastáticos (S-BM e M-BM).
(D) Gráfico mostrando alterações no número de oncosfera depleção de
LDHA em células HCC1954 S-BM e M-BM.
(E e F) Efeito da depleção de LDHA mediada por shRNA induzível por doxiciclina em S-BM (S-BM-KD
LDHA ) e M-BM (M-BM-KD
LDHA ) na incidência metastática cerebral.
(G) Aumento da doença residual em camundongos portadores de M-BM depletados de LDHA (M-BM-KD
LDHA ) em comparação com S-BM-KD
LDHA .
(H) A
coloração vermelho profundo de ROX da célula seguida por análises de citometria de fluxo destaca o aumento de
ROS em KD LDHA S-BM, mas não em M-BM.
(I) N-acetil-L-cisteína (NAC; 1 mM) resgata a capacidade das células S-BM-KD
LDHA de formar oncosferas.
Para avaliar diretamente o impacto da limitação da produção e secreção de lactato, transduzimos S-BM e M-BM com pequenos RNAs hairpin induzíveis por doxiciclina (dox) (shRNAs ) direcionados à lactato desidrogenase A (LDHA), a enzima responsável pela conversão de piruvato em lactato ( Figura S5 E). Uma redução significativa da produção de lactato extracelular foi observada em relação ao shRNA de controle nas linhas HCC1954 S-BM e M-BM ( Figura 5 C). Taxa de acidificação extracelular reduzida e taxa de consumo de oxigênio aumentada (OCR) foram observadas em derivados metastáticos com depleção de LDHA ( Figuras S5 F–S5I). Nenhum efeito sobre a proliferação celularfoi observado em culturas 2D; no entanto, a depleção de LDHA reduziu significativamente a formação de oncosfera em S-BM em relação a M-BM ( Figuras 5 D e S5 J). Consistente com nossos achados anteriores, um aumento significativo no IFN – γ secretado pelas células NK foi observado na presença de sobrenadante de S-BM e M-BM depletados em LDHA ( Figuras S5 K e S5L).
Em seguida, para avaliar o efeito da depleção de LDHA no potencial metastático , injetamos intracardialmente camundongos com células S-BM e M-BM transduzidas com shRNAs induzíveis por dox visando LDHA e induzimos a depleção de LDHA pós-extravasamento. A incidência de metástase cerebral reduzida foi observada em S-BM e M-BM, conforme mostrado por imagens cerebrais ex vivo ( Figuras 5 E e 5F). Semelhante às nossas observações anteriores com o tratamento com oxamato de sódio e formação de oncosfera, a diferença na incidência metastática foi impressionante em HCC1954 S-BM em comparação com M-BM. Para avaliar minuciosamente o impacto da depleção de LDHA em S-BM e M-BM, seccionamos os cérebros e examinamos a doença residual. Surpreendentemente, mais células M-BM depletadas em LDHA residuais foram observadas em cérebros de camundongos em comparação com células S-BM depletadas em LDHA ( Figuras 5 G e S5 M).
OCRs aumentados observados em S-BM e M-BM após a depleção de LDHA ( Figuras S5 H e S5I) podem resultar em aumento do estresse oxidativo e promover a morte celular. Em relação a S-BM, Lat e M-BM tiveram comparativamente baixas espécies reativas de oxigênio celular (ROS) e alta razão glutationa reduzida (GSH)/glutationa oxidada (GSSG) ( Figuras S5 N-S5P). A análise de metabólitos em estado estacionário in vivo também mostrou níveis aumentados de cisteína e glutationa em lesões M-BM em comparação com S-BM ( Figuras S5 Q e S5R). A depleção de LDHA resulta em aumento adicional de ROS celulares em S-BM, enquanto tal aumento não foi observado em M-BM ( Figura 5H), sugerindo que os M-BM estão mais bem equipados para lidar com o estresse oxidativo. De fato, a administração de antioxidante N-acetil-L-cisteína (NAC) resgatou a redução observada no tamanho da oncosfera após a perda de LDHA em S-BM ( Figura 5 I). No geral, esses dados sugerem que a incapacidade de lidar com redox celular alterada após a depleção de LDHA em células S-BM resulta em seu desaparecimento e redução da metástase. As células M-BM, por outro lado, foram melhores na modulação do status redox celular e, portanto, capazes de sobreviver como doença residual.
xCT medeia a latência metastática
Várias observações sugeriram que a troca de glutamato intracelular foi fundamental para manter o equilíbrio redox celular em células Lat e M-BM: (1) ROS celular reduzido com alta razão GSH/GSSG ( Figuras S5 N-S5P) e aumento da secreção de glutamato foi observado em ambos derivados Lat e M-BM ( Figuras 1 G, 1H, 2H , S1K e SIL); (2) a depleção de LDHA em células M-BM resultou em doença residual sem diferença significativa nos níveis de ROS celulares ( Figuras 5 G, 5H e S5 M); (3) as subunidades antiportadoras de cistina/glutamato xCT SLC7A11 e SLC3A2 , que importam cistina para as células enquanto exportam glutamato, foram enriquecidas em Lat e M-BM (Figura S6A ); e (4) células Lat e M-BM cultivadas em meio sem cistina apresentaram redução da secreção de glutamato, consumo de glutamina e viabilidade celular e aumento de ROS ( Figuras S6 B–S6F). Além disso, foi relatado que a limitação da função xCT atenua o crescimento e a progressão do tumor ( Chen et al., 2009 ; Conti et al., 2020 ; LeBoeuf et al., 2020 ; Liu et al., 2020 ). Portanto, examinamos o papel da xCT na promoção da sobrevivência de células de câncer de mama HER2+ metastáticas no cérebro e Lat.
Primeiro, avaliamos ROS celulares e níveis de glutamato secretados em derivados de HCC1954 e SKBR3 Lat e M-BM na presença de erastina, um conhecido inibidor farmacológico de xCT ( Dixon et al., 2012 ). Uma redução significativa na secreção de glutamato, consumo de glutamina e viabilidade celular foi observada em células disseminadas Lat e M-BM ( Figuras 6 A, 6B, S6 G e S6H). A razão GSH/GSSG diminuída e um aumento concomitante de ROS também foram observados nessas células após o tratamento com erastina ( Figuras 6 C, 6D e S6 I). O aumento observado no lactato secretado por M-BM também foi atenuado na presença de erastina ( Figura 6E). Além disso, a administração de erastina a camundongos portadores de M-BMs resultou em redução significativa da incidência metastática ( Figuras 6 F e S6 J) sem efeitos adversos significativos ( Figura S6 K).
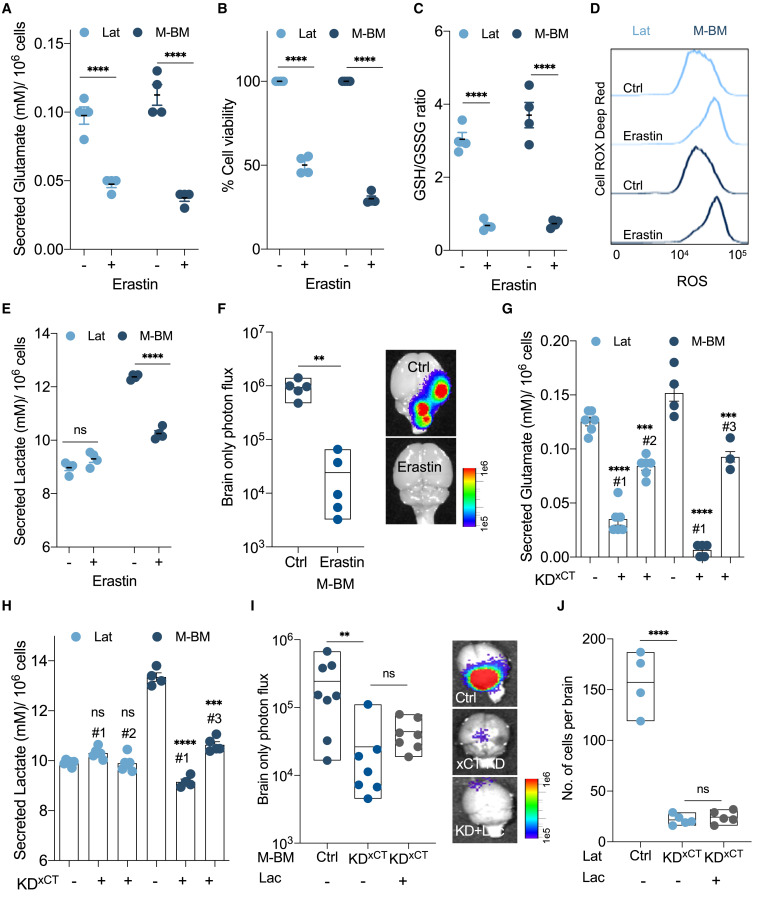
xCT medeia a latência metastática
(A) As células HCC1954 Lat ou M-BM foram tratadas com 20 μM de erastina, inibidor farmacológico de xCT ou ctrl (DMSO, 0,2%) e o
glutamato secretado foi medido pelo BioProfile 400.
(B) Dados de ensaio de brometo de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazólio (MTT) mostrando efeito de erastina (20 μM, 24 h) em células HCC1954 Lat e M-BM.
(C) Gráfico representativo destacando uma diminuição significativa na razão GSH/GSSG após o tratamento com erastina (24 h) em células Lat e M-BM.
(D) A análise de citometria de fluxo de coloração vermelho escuro Cell ROX
mostra
espécies reativas de oxigênio aumentadas (ROS) no tratamento com erastina.
(E) A análise do BioProfile 400 mostra redução no lactato secretado em M-BMs tratados com erastina.
(F) Fluxo de fótons apenas no cérebro e imagens cerebrais
ex vivo mostrando carga metastática em camundongos portadores de M-BMs tratados com erastina (administração oral: 30 mg/kg de peso corporal, erastina em
DMSO a 5%, metilcelulose a 0,2% , uma vez ao dia; dois dias após a injeção intracardíaca) por 5 semanas.
As imagens foram adquiridas 6 semanas após a injeção. ∗∗ p < 0,01:
Teste t de Student .
(G e H) Dados do BioProfile 400 mostrando efeito diferencial da depleção de xCT na secreção de glutamato e lactato em células HCC1954 Lat e M-BM.
(I) Mostrando fluxo de fótons apenas no cérebro e imagem cerebral
ex vivo de camundongos injetados com M-BM (shCtrl, KD
xCT e KD
xCT +lac) e tratados com
doxiciclina .
(J) Número significativamente reduzido de células Lat positivas para GFP em cérebros de camundongos após depleção de xCT e em camundongos injetados com células Lat depletadas de xCT suplementadas com lactato 2 semanas após a injeção.
Em seguida, esgotamos xCT em células HCC1954 Lat e M-BM usando shRNAs induzíveis por dox. A perda de xCT resultou em secreção reduzida de glutamato, consumo reduzido de glutamina e aumento de ROS celular ( Figuras 6 G, S6 L e S6M). Além disso, a depleção de xCT em células ME high M-BM resultou na redução dos níveis de lactato secretado ( Figura 6 H), semelhante ao tratamento com erastina ( Figura 6 E). A depleção de xCT também atenuou a formação e o tamanho da oncosfera em células Lat e M-BM ( Figura S6 N). A administração do antioxidante NAC resultou no aumento da formação e tamanho da oncosfera em células Lat e M-BM depletadas de xCT ( Figura S6N). Esses estudos mostram que a função limitante de xCT resulta em aumento de ROS celulares em células Lat e M-BM e atenua a secreção de lactato em células M-BM, sugerindo que a homeostase redox celular mediada por xCT promove a sobrevivência e a adaptação metastática das células Lat e M-BM.
Para avaliar o efeito de xCT na sobrevivência de células cancerosas disseminadas no cérebro, administramos dox para induzir a depleção de xCT em derivados Lat e M-BM. A incidência metastática reduzida foi observada em células M-BM com depleção de xCT em comparação com seus controles, conforme mostrado pelo fluxo de fótons apenas no cérebro ( Figuras 6 I e S6 O). Observamos uma redução significativa no número de células residuais em todo o cérebro. Da mesma forma, o número de células cancerígenas positivas para GFP disseminadas foi significativamente reduzido em camundongos com células Lat depletadas de xCT em comparação com shRNA de controle ( Figura 6J). Além disso, como a suplementação de lactato limita a atividade das células NK e facilita surtos metastáticos, administramos lactato a camundongos 2 semanas após a injeção de células Lat e M-BM com depleção de xCT. Não foi observada metástase evidente ou aumento no número de células tumorais residuais, afirmando a eliminação da doença residual ( Figuras 6 I, 6J e S6O ).
A inibição de xCT sensibiliza Lat e M-BM a inibidores de HER2
Em seguida, realizamos a avaliação imuno-histoquímica da expressão de xCT em sete pacientes com câncer de mama HER2/linfonodos primários e lesões metastáticas M-BM coletadas de mais de um ano a mais de uma década após o tratamento primário ( Tabela S3 ). A análise de histoscore mostrou expressão de xCT significativamente alta em lesões metastáticas cerebrais em comparação com tumores primários correspondentes ( Figura 7 A). Por outro lado, a baixa expressão de xCT foi observada em amostras metastáticas de linfonodo de pulmão e pescoço obtidas de dois pacientes com câncer de mama HER2 ( Figura 7 B). Como a depleção ou inibição farmacológica de xCT resultou em metástase reduzida, avaliamos o potencial de direcionar xCT em combinação com os inibidores de tirosina quinase HER2 lapatinibou tucatinib , terapias sistêmicas aprovadas para pacientes com câncer de mama metastático HER2+. Ambos HCC1954 e SKBR3 Lat e M-BMs eram resistentes a lapatinib e tucatinib como agentes únicos em relação às suas células parentais ( Figuras 7 C, 7D e S7 A). Em contraste, HCC1954 S-BM foi sensível ao lapatinib e tucatinib como agentes únicos e formou menos oncosferas em relação ao controle ( Figura 7 C). Erastin não conseguiu bloquear o crescimento de oncosferas HCC1954 S-BM e não teve nenhum benefício adicional na presença de HER2 TKIs ( Figura 7 C).
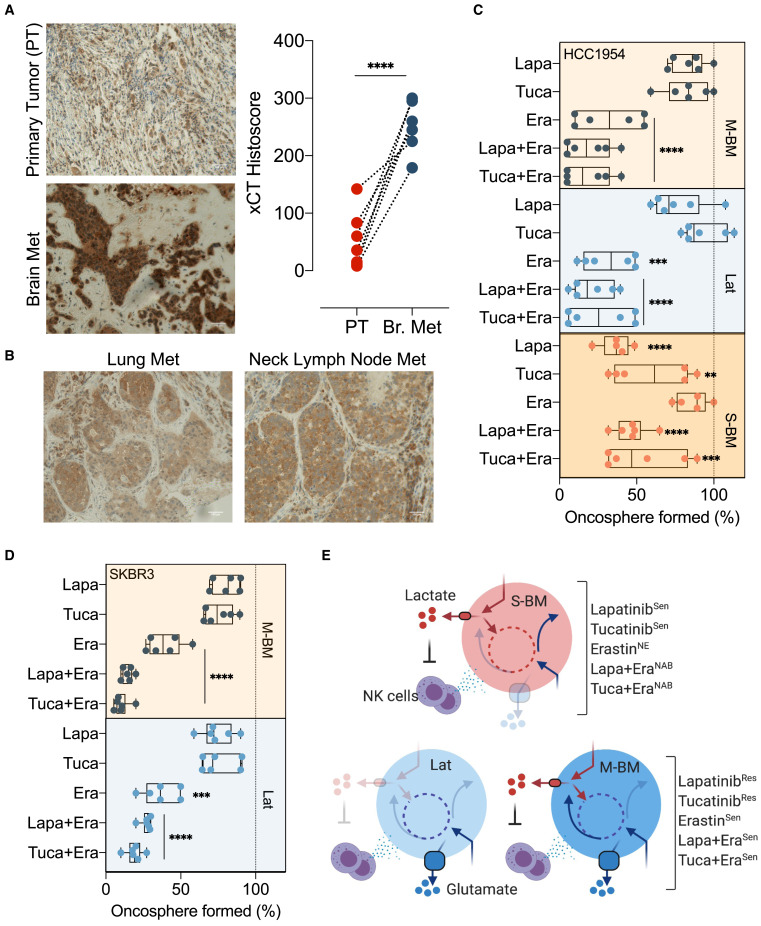
A inibição de xCT sensibiliza Lat e M-BM a
inibidores de
HER2
(A) Coloração imuno-histoquímica (IHC)
para xCT (1:100, DAB, 20X) em tumor primário HER2+ humano compatível e metástases cerebrais (painel esquerdo).
Gráfico representativo mostrando o histoscore xCT em amostras de tumor primário e cérebro HER2+ (painel direito).
(B) coloração xCT em amostras metastáticas de
linfonodo de pulmão e pescoço obtidas de pacientes com câncer de mama HER2+.
(C e D) Gráficos de barras mostrando a sensibilidade diferencial de inibidores de HER2 (2 μM de
lapatinib e 3 μM de tucatinib) e inibidor de xCT (5 μM de erastina) sozinho ou em combinação em HCC1954 (S-BM, Lat e M-BM) ou
Oncosferas
SKBR3 (Lat e M-BM)
.
(E) Ilustração destacando as diferenças metabólicas nas células S-BM, Lat e M-BM juntamente com suas sensibilidades aos inibidores de HER2 – lapatinibe,
tucatinibe e inibidor de xCT erastina como agente único ou em combinação (Sen, sensível; NE, não eficaz ; Res, resistente; NAB, sem benefício adicional).
Ambos os derivados HCC1954 e SKBR3 Lat e M-BM formaram oncosferas significativamente reduzidas na presença de erastina; este número foi ainda mais reduzido na presença de lapatinib ou tucatinib ( Figuras 7 C e 7D). Estendemos esses estudos para outras linhas celulares de câncer de mama HER2+ . As células BT474 e HCC1569 amplificadas pelo gene HER2 foram sensíveis a lapatinib e tucatinib, enquanto MDA-361 e HCC202 foram resistentes. A administração de erastina sensibilizou todas as linhagens celulares aos HER2 TKIs. ( Figuras S7B e S7C).
Discussão
Os CDTs sofrem adaptações metabólicas para sobreviver em órgãos distais ( Bergers e Fendt, 2021 ; Elia et al., 2018 ; Faubert et al., 2020 ; Lehuédé et al., 2016 ; Li e Simon, 2020 ). Aqui, descobrimos a diversidade metabólica e as vulnerabilidades segmentáveis de células de câncer de mama com superexpressão de HER2 cerebral com aptidão metastática variada ( Figuras 7 E e S7 D). A incorporação desse conhecimento e o desenvolvimento de regimes terapêuticos precisos para pacientes com câncer apresentados com metástases cerebrais S-BM, Lat ou M-BM têm o potencial de melhorar a sobrevida livre de doença.
A plasticidade metabólica molda a aptidão metastática
A glicose e a glutamina são nutrientes essenciais exigidos pelas células cancerígenas em proliferação para apoiar a bioenergética e a biossíntese celular ( DeBerardinis e Chandel, 2016 ). O cérebro dos mamíferos depende da glicose como sua principal fonte de energia; portanto, o metabolismo da glicose é fortemente regulado em comparação com a glutamina, que está disponível em abundância ( Chen et al., 2015 ; DeBerardinis e Cheng, 2010 ). Nossos dados revelam que a plasticidade metabólica na utilização de glicose e glutamina por células disseminadas de câncer de mama cerebral-trófico molda o resultado metastático.
Esses dados suportam um modelo no qual a disponibilidade de nutrientes e a capacidade de utilização dos DTCs no cérebro determinam o resultado metastático. Após o extravasamento, os DTCs que não conseguem competir com as células próximas pela captação de glicose ou metabolizar eficientemente a glutamina perecem. Células cancerosas HER2+ trópicas ao cérebro que competem com as células próximas pela captação de glicose, metabolizam o lactato e negam a vigilância imunológica inata podem iniciar metástases cerebrais S-BM. Em contraste, células disseminadas que utilizam glutamina disponível em abundância como fonte primária de energia sobrevivem como entidades latentes; essas células podem se adaptar e reprogramar o microambiente circundantepara iniciar metástases assíncronas ou metacrônicas tardias. Condutas metabólicas adicionais dependentes de ácidos graxos abundantemente disponíveis, corpos cetônicose acetato também podem ser exploradas por células metastáticas cerebrais HER2+ residuais e merecem investigação adicional.
A homeostase redox celular mediada por xCT é crítica para células metastáticas cerebrais residuais latentes
Para nossa surpresa, a interferência farmacológica ou genética do metabolismo do lactato teve um efeito diferencial nas células metastáticas S-BM e M-BM. Um aumento significativo de ROS e morte celular foi observado ao direcionar LDHA em células metastáticas S-BM. Em contraste, as células M-BM com depleção de LDHA foram capazes de manter o status redox celular e sobreviver como doença residual. Demonstramos que o redox celular dependente de xCT em células metastáticas Lat e M-BM é fundamental para sua sobrevivência. Além disso, a expressão de xCT foi alta em amostras metastáticas cerebrais M-BM correspondentes de pacientes com câncer de mama HER2 . A administração do antioxidante NAC é eficaz na limitação de EROs celulares e na promoção da oncosferaformação em células trópicas cerebrais com depleção de LDHA, enquanto limita a função xCT resulta em metástase atenuada e melhor sobrevida. Nossos achados estão de acordo com estudos que mostram que o estresse oxidativo é um impedimento à progressão metastática ( Le Gal et al., 2015;Piskounova et al., 2015). Uma melhor compreensão dos circuitos metabólicos redox nas células cancerígenas é indispensável para limitar a doença metastática (Wang et al., 2019).
Metabolismo do lactato e vigilância imunológica inata comprometida
As células cancerígenas que entram em latência pós-extravasamento sobrevivem em equilíbrio com a vigilância imune inata, regulando negativamente os ligantes de ativação das células NK da superfície celular e os receptores de morte celular ( Malladi et al., 2016 ). O efluxo de lactato em células metastáticas S-BM e M-BM atenuou a citotoxicidade das células NK e acelerou o escape da vigilância imune inata, enquanto a depleção ou o direcionamento farmacológico do LDHA para limitar o metabolismo do lactato reduziu as metástases. Além disso, o aumento da expressão de ME e malato desidrogenase em metástases de M-BM é fundamental para o metabolismo do lactato. No geral, o efluxo de lactato das células cancerígenas pode modular a resposta imune ou ser reutilizado pelas células tumorais ( Brand et al., 2016; Chen et al., 2016 ; Colegio et al., 2014 ; Dietl et al., 2010 ; Faubert et al., 2017 ; Li e Simon, 2020 ; Nakajima e Van Houten, 2013 ). Nossos dados sugerem fortemente que limitar o metabolismo do lactato em células metastáticas cerebrais HER2+ agressivas pode promover sua morte ou forçar a latência metastática. O perfil metabólico abrangente do secretoma da célula cancerosa metastática pode identificar metabólitos imunomoduladores adicionais que auxiliam a colonização metastática.
Implicações terapêuticas
As terapias sistêmicas atuais direcionadas à doença metastática cerebral HER2+ não são curativas, e os pacientes com metástases cerebrais S-BM, Lat ou M-BM são tratados com os mesmos regimes, apesar das diferenças na apresentação clínica. Nosso estudo sugere várias abordagens potenciais para limitar a doença residual e o crescimento de metástases cerebrais. Primeiro, direcionar o metabolismo do lactato ressuscita a vigilância imune inata e resulta na eliminação de células metastáticas agressivas que não possuem capacidade de modulação redox. Em segundo lugar, a inibição farmacológica do metabolismo de xCT (com erastin) ou glutamina em combinação com os atuais medicamentos anti-HER2 padrão de tratamento é terapeuticamente benéfico para limitar a doença residual, potencialmente retardando a recidiva metastática. O análogo de erastina PRLX 93936 está atualmente em testes clínicos emmieloma múltiplo (NCT01695590); o uso clínico ou ensaios desta estratégia para retardar a metástase cerebral em pacientes com câncer de mama metastático HER2+ são garantidos. Finalmente, esses achados também podem ter aplicabilidade terapêutica mais ampla para outros cânceres com propensão a se disseminar para o cérebro.
Limitações do Estudo
Ao empregar novos modelos S-BM, Lat e M-BM do cérebro, definimos determinantes metabólicos da aptidão metastática em células metastáticas cerebrais de câncer de mama HER2 e sua capacidade de sobreviver em equilíbrio ou escapar da vigilância imune inata. O desenvolvimento de modelos de metástase cerebral de câncer de mama geneticamente modificados que mimetizam doenças humanas provavelmente fornecerão uma análise mais abrangente da aptidão metastática na presença de vigilância imune inata e adaptativa ativa. A administração de erastin teve potência impressionante em modelos de xenoenxerto de camundongo. Como candidato a ensaio clínico prospectivo, a administração de erastin ou seu análogo PRLX 93936 precisa de otimização adicional e teste de xenoenxertos derivados de pacientes metastáticos no cérebro em combinação com o padrão atual de atendimento.
Tabela de recursos-chave
| REAGENTES ou RECURSOS | FONTE | IDENTIFICADOR |
|---|---|---|
| Anticorpos | ||
| Coelho monoclonal anti-xCT/SLC7A11 | Tecnologia de Sinalização Celular | Cat# 12691S; RRID: AB_2687474 |
| Anti-SLC3A2 monoclonal de coelho | Tecnologia de Sinalização Celular | Cat# 13180S; RRID: AB_2687475 |
| Anti-SLC1A3 monoclonal de coelho | Tecnologia de Sinalização Celular | Cat# 14501S; RRID: AB_2798499 |
| Anti-LDHA monoclonal de coelho | Tecnologia de Sinalização Celular | Cat# 3582S; RRID: AB_2066887 |
| Anti-ME policlonal de coelho | Tecnologia de Sinalização Celular | Cat# 12399S; RRID: AB_2797899 |
| Anti-ENO1 policlonal de coelho | Tecnologia de Sinalização Celular | Cat# 3810S; RRID: AB_2246524 |
| Anti-beta Actina monoclonal de camundongo | Abcam | Cat# ab49900; RRID: AB_867494 |
| Anti-Luciferase Policlonal de Coelho | Abcam | Cat# ab21176, RRID: AB_446076 |
| Coelho policlonal anti-MCT4 | Milíporo | Cat# AB3314P; RRID: AB_2286063 |
| Anti-GFP policlonal de coelho | Termopescador | Cat# PA5-22688; RRID: AB_2540616 |
| Anti-NKp46 policlonal de cabra | Sistemas de P&D | Cat# AF2225; RRID: AB_355192 |
| Coelho policlonal anti-Ki67 | Abcam | Cat#ab15580, RRID: AB_443209 |
| Rato anti-CD45-Alexa Fluor 488 | Bio-Lenda | Cat#103121, RRID: AB_493532 |
| Rato anti-CD11b-BV785 | Bio-Lenda | Cat#101243, RRID: AB_2561373 |
| Rato anti-Ly6G-APC | Bio-Lenda | Cat#127613, RRID: AB_1877163 |
| Rato anti-F4/80- PerCP/Cy5.5 | Bio-Lenda | Cat#123127, RRID: AB_893496 |
| Anti-CD335/NKp46-BV510 de camundongo | Bio-Lenda | Cat#137623, RRID: AB_2563290 |
| Amostras biológicas | ||
| Amostras de pacientes com câncer de mama | Centro de Câncer Vanderbilt Ingram | N / D |
| Amostras de pacientes com câncer de mama | Centro Médico UT Southwestern | N / D |
| Produtos químicos, peptídeos e proteínas recombinantes | ||
| RPMI-1640 | Sigma-Aldrich | Cat# R8758 |
| RPMI-1640 – Glutamina, – Glicose | Indústrias Biológicas | Cat# SKU: 01-101-1A |
| Penicilina-Estreptomicina | Sigma-Aldrich | Cat# P0781 |
| L-Glutamina | Sigma-Aldrich | Cat# G7513 |
| DMEM F12 | GIBCO | Cat#12634-010 |
| Opti-MEM | GIBCO | Cat# 31985-070 |
| D-(+) Glicose | Sigma-Aldrich | Cat# G8270-1KG |
| Pepstatina A | Tocris Biociência | Cat# 1190 |
| Hemissulfato de leupeptina | Tocris Biociência | Gato # 1167 |
| Aprotinina | Tocris Biociência | Cat# 4139 |
| Ortovanadato de sódio | Sigma-Aldrich | Cat# 450243 |
| Fluoreto de Sódio | Sigma-Aldrich | Cat# 450022 |
| Brometo de azul de tiazolil tetrazólio | Sigma-Aldrich | Cat# M5655-1G |
| Interleucina-2, humana (hIL-2) | Sigma-Aldrich | Cat# 10799068001 |
| Interleucina-2, camundongo (mIL-2) | Sigma-Aldrich | Cat# 11271164001 |
| 2-Mercaptoetanol | Tecnologias de vida | Cat# 21985-023 |
| Tampão de Lise ACK | Termocientífico | Cat# A1049201 |
| Calceína AM | Termocientífico | Cat# 65-0853-78 |
| Dimetilsulfóxido (DMSO) | Sigma-Aldrich | Cat# D2650 |
| D-Glicose ( 13 C 6 ) | Laboratório de isótopos de Cambridge. | Cat# CLM-1396-1 |
| Glutamina ( 13 C 5 ) | Laboratório de isótopos de Cambridge. | Cat# CLM-184161-19-1 |
| Reagente Vermelho Profundo CellROX | Termocientífico | Cat# C10422 |
| Cloridrato de Doxiciclina | Sigma-Aldrich | Cat# D3072 |
| Metilcelulose | Sigma-Aldrich | Cat# M6385-100G |
| L-cistina | Sigma-Aldrich | Cat# C7602-25G |
| RPMI-1640 | Sigma-Aldrich | Cat# R7513 |
| L-Metionina | Sigma-Aldrich | Cat# M9625-25G |
| FBS, dialisado, origem nos EUA | Termocientífico | Cat# A3382001 |
| Ácido oxâmico | Sigma-Aldrich | Cat# O3750-25G |
| Lactato de sódio | Sigma-Aldrich | Cat# L7022 |
| Ácido lático | Sigma-Aldrich | Cat# L6661 |
| Erastin | Selleck EUA | Cat# S7242 |
| Erastin | Medchem express | Cat# HY-15763 |
| Estiripentol | Selleckchem | Cat# 5266 |
| Tucatinibe (Irbinitinibe, ONT-380) | Selleckchem | Cat# S8362 |
| Lapatinib (10mM/1mL em DMSO) | Selleckchem | Cat# S2111 |
| Neratinibe (HKI-272) | Selleckchem | Cat# S2150 |
| N-acetil-L-cisteína | Sigma-Aldrich | Cat# A8199-10G |
| 4% de paraformaldeído em PBS | Santa Cruz | Cat# sc-281692 |
| hEGF | Sigma-Aldrich | Cat# E9644-.5MG |
| bFGF | Merck | Cat# GF003-AF |
| Meio Basal Sem Soro HuMEC | Termocientífico | Cat# 12753018 |
| Proteína Insulina Humana Recombinante | Novus Biológicos | Cat# NBP2-26530 |
| Suplemento B-27 (50X), sem soro | Termocientífico | Cat# 17504044 |
| Opti-MEM | Termocientífico | Cat# 31985070 |
| Lipofectamina 3000 | Thermo Fisher (Invitrogen) | Cat# L3000015 |
| Seahorse XF RPMI Médio (500ml) | Tecnologias Agilent | Cat# 103336-100 |
| Composto Tissue-Plus OCT | Saúde de Fisher | Cat# 23-730-571 |
| Sal de potássio D-Luciferina | Biotecnologia de ouro | Gato#LUCK-5G |
| Ensaios comerciais críticos | ||
| Kit de teste de estresse Mito | Tecnologias Agilent | Cat# 103015-100 |
| Kit de ensaio de taxa glicolítica | Tecnologias Agilent | Cat# 103344-100 |
| Kit de teste de estresse de glicólise | Tecnologias Agilent | Cat# 103020-100 |
| Kit de ensaio fluorométrico de glutationa | Biovisão | Cat# K-264 |
| Kit de ensaio CellTiter-Glo | Promega | Cat# G7571 |
| Human Granzyme B DuoSet ELISA | Sistemas de P&D | Cat# DY2906-05 |
| Mouse Granzyme B DuoSet ELISA | Sistemas de P&D | Cat# DY1865-05 |
| Kit de reagente auxiliar DuoSet ELISA 2 | Sistemas de P&D | Cat# DY008 |
| Kit ELISA de IFN-gama humano | Sistemas de P&D | Cat# DIF50 |
| Kit ELISA de IFN-gama de camundongo | Sistemas de P&D | Cat# MIF00 |
| Kit de Isolamento de Células NK, camundongo | MACS Miltenyi Biotec | Cat# 130-115-818 |
| Supermix verde IQ SYBR | Bio-Rad | Cat# 1708880 |
| Kit de Viabilidade Fixável Zombie NIR | Bio-Lenda | Cat# 423106 |
| Modelos experimentais: Linhas celulares | ||
| HCC1954 PA | ATCC | CRL-2338 |
| HCC1954 S-BM, Lat e M-BM | Este papel | N / D |
| SKBR3 PA | ATCC | HTB-30 |
| SKBR3 Lat e M-BM | Este papel | N / D |
| MMTV PA, BM1, BM2 | Er et al., 2018 | N / D |
| MMTV-HER2-PIK3CA H1047R | Hanker et al., 2013 | N / D |
| HCC202 | ATCC | CRL-2316 |
| HCC1569 | ATCC | CRL-2330 |
| BT474 | ATCC | HTB-20 |
| MDA-361 | ATCC | HTB-27 |
| HEK293 | ATCC | CRL-1573 |
| Modelos experimentais: Organismos/cepas | ||
| Rato: Hsd: Ratos nus atímicos-Foxn1 nu | Envigo | Cat#069 |
| Mouse: NOD.Cg- Prkdc scid Il2rg tm1Wjl /SzJ | Laboratório Jackson | Cat#005557 |
| Oligonucleotídeos | ||
| shRNA: LDHA-KD1 humano | Dharmacon | Cat# RHS4696-200774439 |
| shRNA: LDHA-KD2 humano | Dharmacon | Cat# RHS4696-200778151 |
| shRNA: humano SLC7A11-KD xCT #1 | Dharmacon | Cat# RHS4696-200759835 |
| shRNA: humano SLC7A11-KD xCT #2 | Dharmacon | Cat# RHS4696-200710181 |
| shRNA: humano SLC7A11-KD xCT #3 | Dharmacon | Cat# RHS4696-200758664 |
| siRNA: Scramble humano | Dharmacon | Cat# D-001810-01-05 |
| siRNA: ME1 humano | Dharmacon | Cat# L-009348-00-0005 |
| siRNA: ME2 humano | Dharmacon | Cat# L-009461-01-0005 |
| iniciadores q-PCR, consulte a Tabela S2 | Este papel | N / D |
| Software e algoritmos | ||
| GraphPad Prism versão 8.0.0 | Software GraphPad | https://www.graphpad.com/scientific-software/prism/ |
| ClustVis (Beta) | ClustVis | https://biit.cs.ut.ee/clustvis/ |
| Imagem viva 4.5 | Perkin Elmer | https://www.perkinelmer.com/ |
| Biorenderização | Biorenderização | https://biorender.com/ |
| Análise de enriquecimento do conjunto de genes | Instituto Amplo | http://www.gsea-msigdb.org/gsea/index.jsp |
Disponibilidade de recursos
Contato principal
Mais informações e solicitação de recursos e reagentes devem ser direcionadas ao contato principal, Srinivas Malladi ( srinivas.malladi@utsouthwestern.edu )
Disponibilidade de materiais
As linhas celulares geradas neste estudo estão disponíveis no contato principal mediante solicitação.
Modelo experimental e detalhes do assunto
Pacientes e amostras de tumor
As amostras de pacientes com câncer de mama do sexo feminino (HER2+) foram obtidas do Programa de Pesquisa do Câncer de Mama, Vanderbilt Ingram Cancer Center e Departamento de Patologia, UT Southwestern Medical Center com consentimento voluntário do paciente. A idade dos pacientes não foi divulgada. Seções de tecido de 5 μm embebidas em parafina não coradas foram obtidas e coradas para xCT para análise subsequente.
Camundongos
Todos os estudos em animais foram realizados de acordo com as diretrizes do Comitê Institucional de Cuidados e Uso de Animais da UTSW (Protocolo nº 2017-102099). Camundongos atímicos fêmeas de 4-5 semanas de idade (Hsd: camundongos nus atímicos-Foxn1 nu ) e camundongos NSG (NOD.Cg- Prkdc scid Il2rg tm1Wjl /SzJ) foram adquiridos da Envigo (#069) e do laboratório Jackson (#005557) foram permitidos para se aclimatar à condição de alojamento em instalações para animais por 1 semana antes do uso para os experimentos. Os animais utilizados para toda a experiência tinham idades compreendidas entre 5-6 semanas. Todos os camundongos foram alojados na sala de animais da UT Southwestern, mantidos em um ciclo claro/escuro de 12/12 h a uma temperatura de 20-26°C com 30%-50% de umidade e alimentados com dieta Teklad padrão (Envigo, #2916) . Em doxiciclina induzívelknockdown mediado por shRNA , os camundongos foram alimentados com dieta de doxiciclina (Envigo, #TD.08541). Acesso ad libitum a comida e água foi fornecido aos camundongos em todos os momentos. A saúde dos animais foi monitorada uma vez ao dia durante toda a linha do tempo do experimento.
Linhas de celular
As células HCC1954 (PA, S-BM, Lat, M-BM), SKBR3 (PA, Lat, M-BM), BT474, HCC1569, MDA-361, HCC202 foram cultivadas em RPMI 1640 e MMTV-HER+2 (PA, As células BM1, BM2) foram cultivadas em meio F/12 DMEM. O meio foi suplementado com 10% de FBS, 2 mM de glutamina, 100 unidades/L de penicilina, 100 mg/L de estreptomicina e 1 μg/mL de anfotericina B. As células MMTV-PIK3CA H1047R foram cultivadas em DMEM F12 suplementado com 10% de FBS, 2 mM de glutamina, 100 unidades/L de penicilina, 100 mg/L de estreptomicina e 1 μg/mL de anfotericina B juntamente com 10ng/mL de EGF, 5μg/mL de insulina, 5 μg/mL de dexametasona , 2nM de progesterona . As células foram mantidas em incubadora a 37°C com 5% de CO 2 e divididas a cada 3 dias na diluição de 1:4.
Detalhes do método
Isolamento de células metastáticas cerebrais de câncer de mama HER2+ sincrônicas, latentes e metacrônicas
Camundongos atímicos foram usados para isolar células isogênicas síncronas (S-BM), residuais latentes (Lat) e metastáticas metacrônicas (M-BM) de células de adenocarcinoma de mama HCC1954 e SKBR3 HER2+ transduzidas com GFP-luciferase e vetores de resistência a antibióticos. Resumidamente, 2,5 x 10 6 células foram ressuspensas em PBS e Matrigel (proporção 1:1) em 1 ml. Os camundongos foram anestesiados por administração controlada de isoflurano através de um cone de nariz em um capuz estéril. Uma incisão foi feita entre o quarto e quinto mamilo do rato para expor o coxim de gordura mamária, e 100 μL da suspensão celular foi injetado usando uma seringa de insulina 28G. A progressão do tumor e a incidência metastática foram rastreadas semanalmente por imagem bioluminescente (BLI) usando IVIS (In Vivo Imaging System) Spectrum (PerkinElmer). A intensidade de sinalização de bioluminescência foi medida usando a ferramenta ROI em software de imagem viva. A metástase evidente foi identificada pelo sinal BLI e as linhas celulares HCC1954 S-BM, HCC1954 M-BM e SKBR3 M-BM foram geradas. De cérebros de camundongos sem sinal de BLI, células residuais latentes (HCC1954 Lat; SKBR3 Lat) foram isoladas conforme descrito anteriormente ( Malladi et al., 2016 ). Para a RM, os camundongos foram anestesiados com isoflurano e a frequência respiratória foi monitorada durante o procedimento. A imagem foi feita usando 7T Bruker Animal MRI Scanner.
Injeções intracardíacas
1,0 × 10 5 células foram ressuspensas em 100 μL 1X PBS foram injetados intracardialmente no ventrículo esquerdo de camundongos com a ajuda de seringa de tuberculina 26G. A progressão do tumor e a incidência metastática foram monitoradas semanalmente pelo BLI. Para experimentos de depleção de genes induzíveis por dox em camundongos controle Tripz ou shRNA-KD , células LDHA e xCT foram injetadas intracardialmente. 2 dias após a injeção, os camundongos foram alimentados com doxiciclina e monitorados quanto à incidência metastática por BLI.
Traçado de isótopos in vivo e in vitro
Para experimentos de rastreamento de isótopos, os camundongos foram mantidos em jejum durante a noite antes da infusão, então um cateter de calibre 27 foi colocado na veia lateral da cauda sob anestesia. 13 C 6 – glicose (CLM-1396, Cambridge Isotope Laboratories) foi infundido por via intravenosa como um bolus de 0,6 mg/g de massa corporal durante 1 min em 150 μL de solução salina, seguido por infusão contínua de 0,0138 mg/g de massa corporal por min para 3 h (em um volume de 150 μl/h) e 13 C 5 -glutamina (CLM1822, Cambridge Isotope Laboratories) bolus infundido inicial foi de 0,2125mg/g de massa corporal durante 1 min em 150 μL de solução salina, seguido por infusão contínua de 0,004 mg g -1 de massa corporal por minuto por 5 h em um volume de 150 μl/h ( Faubert et al., 2017; Marin-Valência et al., 2012 ). O sangue foi coletado a cada h para monitorar o sucesso da infusão de metabólitos. Após a infusão, os camundongos foram profundamente anestesiados com cetamina , perfundidos intracardialmente com 1x PBS e lesões metastáticas cerebrais rastreadas por BLI foram ressecadas e congeladas em nitrogênio líquido e armazenadas a -80°C. 30-50mg de lesão metastática foi homogeneizada usando um disruptor de tecido eletrônico (QIAGEN) em 1ml de metanol 80% resfriado (grau GC-MS, Fisher Scientific) seguido por três ciclos de congelamento-descongelamento usando nitrogênio líquido e banho-maria a 37°C. O sobrenadante foi coletado e liofilizado usando um Speed-Vac (Thermo) antes de ser executado em GC-MS.
Para experimentos de rastreamento de isótopos in vitro , 1×10 6 células foram cultivadas em placas de 6 cm com 4 ml de meio R3F durante a noite. Células trópicas cerebrais foram cultivadas com glicose 13C6 e glutamina não marcada ( marcação de glicose 13C6), ou glicose não marcada com glutamina 13C5 ( marcação glutamina 13C5 ) por 8 h . Após a incubação, o sobrenadante da mídia foi coletado e as células foram rapidamente lavadas usando 300 μL de NaCl a 0,9% gelada e fixadas com 250 μL de metanol a 80% foi adicionado às placas no gelo seco. A coleta e o processamento da amostra foram feitos de maneira semelhante in vivotraçado isotópico antes de analisado em GC-MS ou LC-MS.
Análise de metabólitos in vivo
Para análise de metabólitos in vivo , lesões metastáticas no cérebro de camundongos foram rastreadas por imagem de bioluminescência usando espectro IVIS (Perkin Elmer) e lesões metastáticas específicas foram removidas cirurgicamente. Os tumores foram congelados em nitrogênio líquido e armazenados a -80°C até o processamento posterior. As lesões metastáticas pesando 30-50mg foram homogeneizadas usando um disruptor de tecido eletrônico (QIAGEN) em 1 ml de metanol 80% resfriado (grau LC-MS, Fisher Scientific) seguido por três ciclos de congelamento-descongelamento usando nitrogênio líquido e banho-maria a 37°C. O sobrenadante foi recolhido após uma centrifugação de 10 min a 13.000 g. O sobrenadante foi recolhido e liofilizado usando um Speed-Vac (Thermo) antes de correr em LC-MS.
Medição de lactato e glutamato extracelular
Para a medição de lactato e glutamato extracelular em oncosferas , 5.000 células/MW-6 foram ressuspensas em meio de oncosfera (meio HuMEC com bFGF 10ng/mL, EGF 20ng/mL, Insulina 5 μg/mL e 1x suplemento de B27) e incubados a 37 °C e 5% de CO2 por 7-8 dias. O sobrenadante do meio foi recolhido e centrifugado antes da análise em BioProfile 400. As oncosferas foram dissociadas com tripsina e as células foram contadas para normalização. Para culturas 2D, 0,5×10 6as células foram cultivadas por 8 h em placa de 6 cm com 4 ml de meio R3F (meio RPMI 1640 suplementado com 3% de FBS, 10 mM de glicose, 2 mM de glutamina, 100 UI/mL de penicilina-estreptomicina). No final de 8 h, o meio foi descartado e as células foram reabastecidas com 1 ml de R3F fresco e mantidas durante a noite. O sobrenadante do meio foi recolhido e processado como descrito anteriormente.
Ensaios de oncosfera
100-400 células foram ressuspensas em meio oncosphere (meio livre de soro HuMEC com bFGF (10ng/mL), EGF (20ng/mL), insulina (5 μg/mL) e suplemento 1XB27) e incubados a 37°C e 5% de CO 2 por 7-8 dias. As oncosferas foram fotografadas usando o microscópio EVOS e quantificadas usando o software ImageJ.
Ensaios de viabilidade celular
A fim de determinar a proliferação celular em várias condições, o ensaio MTT ( Parida et al., 2018 ) ou o ensaio de viabilidade celular luminescente Cell Titer-Glo (Promega) foi realizado em microplacas de parede opaca de 96 poços, planas, de fundo claro, de acordo com protocolo do fabricante.
Western blotting
As células cultivadas em R3F foram colhidas e lisadas com tampão RIPA com inibidor de protease e fosfatase . Para immunoblotting, 20–35 μg de proteína foram resolvidos em 7,5%–15% SDS-PAGE, transferidos para membrana de nitrocelulose (Millipore, EUA), usando um aparelho de transferência semi-seco e bloqueados em 5% de leite TBST por 1 h seguido por incubação com anticorpo primário em BSA a 1% em TBST durante a noite a 4°C. As membranas foram então lavadas em TBST e incubadas com anticorpo secundário seguida de lavagem e reveladas usando supersinal West Femto (Thermofisher) e bio-Rad imager.
Ensaios de cavalos-marinhos
Os kits Mito Stress e Glucose Stress foram usados para comparar as diferenças no uso de energia entre diferentes linhagens celulares. As células foram semeadas em placas de 96 poços e incubadas a 37°C e 5% de CO 2 por 24 h. As sondas foram preparadas durante a noite de acordo com a recomendação do fabricante. Após 24 h a placa foi lavada no tampão e o ensaio foi realizado em Sea Horse XF.
Extração de RNA e RT-PCR quantitativo
O RNA total foi extraído usando o RNeasy Kit (QIAGEN). 0,2-1 μg de RNA foi submetido à transcrição reversa usando reagentes Bio-Rad iScript. Para determinar a expressão relativa de mRNA, a RT-PCR quantitativa foi realizada usando SYBR green Supermix Bio-Rad. Todos os dados de quantificação de mRNA foram normalizados para β-actina. Os iniciadores usados para q-PCR estão listados na Tabela S2 .
Nocaute de shRNA lentiviral
Para gerar células knockdown de shRNA, as células HEK293T foram preparadas e co-transfectadas com pTRIPZ ou pTRIPZ-shRNA do gene alvo com plasmídeo de empacotamento PAX (7μg) e plasmídeo envelope MD2.G (2,7μg) pelo método de lipofecção usando lipofectamina 3000 (Invitrogen) . 18 h após o meio de lipofecção foi trocado com meio fresco e as partículas de vírus foram colhidas após 48 h de incubação. As células cancerosas foram transduzidas com uma proporção de 1:1 de lentivírus colhido para Opti-MEM Pro SFM juntamente com polibreno para uma concentração final de 5μg/mL. Após 6 h de incubação, as células foram reabastecidas com 2-3ml de meio de crescimento fresco e incubadas durante a noite e selecionadas por classificação de fluxo e o knock down foi induzido por suplementação de doxiciclina (1μg/mL).
transfecção de siRNA
Para esta experiência 2×10 6 células foram cultivadas em placa de 10 cm durante 24 h antes da transfecção. As células foram então transfectadas com 10 nM de siRNA codificado ou alvo por lipofectamina 3000 em opti-MEM por 6 h e depois substituídas por RPMI-1640 completo.
Contagem diferencial de leucócitos em sangue periférico de camundongos por citometria de fluxo
O sangue foi coletado da veia submandibular de camundongos nude atímicos usando tubos de EDTA e lisado com tampão de lise ACK. Lavado com tampão FACs (PBS, 3% FBS e 0,5M EDTA). Em todas as condições experimentais, as células mortas foram excluídas usando reagente de coloração fixável por NIR zumbi e os dupletos foram excluídos por Gating FSC-A versus FSC-H e SSC-A versus FSC-H. A seguir, anticorpos primários anti-ratinho marcados diretamente foram usados: CD45-AF 488, CD11b-BV785, F4/80-PerCP/Cy5.5, Ly6G-APC, CD335/NKp46-BV510. O gating e a análise por citometria de fluxo foram feitos conforme mostrado na Figura S3 E usando o software FlowJo .
Ensaios de citotoxicidade NK
Os esplenócitos de camundongos isolados foram dissociados mecanicamente em uma condição estéril e suspensos em tampão de isolamento de esplenócitos (1XPBS, 0,5% BSA, 2mM EDTA, pH 7,2). As células NK foram isoladas a partir dessas suspensões por esgotamento de células não NK usando triagem de células assistida por magnetismo (MACS) usando o Kit de Isolamento de Células NK (método de seleção negativa Miltenyi Biotec). As células NK isoladas foram expandidas em RPMI 1640 contendo 15% de FBS, 50 uM de β-2ME, 2 mM de L-glutamina e 500 U/mL de IL-2 (Roche) recombinante de camundongo durante a noite. Para experimentos de co-cultura, as células alvo marcadas com corante Calcein AM-Red foram incubadas com células NK (relação efetor-alvo de 1:10) por 24 h a 37°C com imagem de lapso de tempo com o imager IncuCyteS3.
Células NK humanas foram cultivadas em meio constituído por [αMEM: sem ribonucleosídeos e desoxirribonucleosídeos , L-glutamina 2 mM, bicarbonato de sódio 1,5 g/L , inositol 0,2 mM ; p-mercaptoetanol 0,1 mM; ácido fólico 0,02 mM] + IL-2 (200 U/mL). Para experimentos de co-cultura, as células NK foram marcadas com Calcein AM-Red e as células cancerígenas alvo marcadas com Green cell tracker dye foram incubadas com proporções de 1:5 por 6 h a 37°C com imagem de lapso de tempo com o imager IncuCyteS3.
Ensaio de ELISA de IFN-γ e granzima-B
Células NK humanas e de camundongos foram cultivadas com sobrenadante filtrado de S-BM, Lat, M-BM em razão de 1:1 (meio NK: Sobrenadante) por 6 h e 24 h, respectivamente. O sobrenadante foi coletado e o ELISA foi realizado de acordo com o protocolo do fabricante (R&D Biosystem).
Análise GSH/GSSG
3×10 6 células foram cultivadas em placa de 10 cm em meio R3F por 24 h a 37°C e 5% de CO2 . Os níveis de glutationa reduzida (GSH) e oxidada (GSSG) foram medidos usando um kit (Cat. K264, BioVision, CA, EUA) de acordo com o protocolo do fabricante. Todos os dados apresentados foram normalizados para 10 6 células.
Medição de ROS de fluorescência
3 x 10 5 células foram plaqueadas em placas de 6 poços por 24 h. As células foram coletadas e lavadas com 3% de FBS em PBS e incubadas com reagente 5μM Cell ROX® Deep Red por 30 min. Após centrifugação a 1.000 rpm por 5 min, os pellets de células foram lavados duas vezes e ressuspensos em 3% de FBS em PBS antes de serem analisados em citômetro de fluxo FACS Calibur (Becton Dickinson).
Imunocoloração: coloração de seções de tecido cerebral parafinizado
Cérebros coletados de camundongos foram fixados em formalina tamponada normalizada a 10% (NBF) durante 48 h antes de serem transferidos para 1X PBS. Os cérebros foram então colocados em blocos de parafina e secções de 5-10 μm foram cortadas e montadas em lâminas. Durante a coloração as lâminas foram desparafinizadas e reidratadas por incubações seriadas em xileno (2X por 3 min), etanol 100% (2X por 3 min), etanol 95% (2X por 3 min), etanol 70% (2X por 3 min) ) e PBS (4X por 3 min). Para evitar que as seções dobrassem ou caíssem, elas foram incubadas em 10%NBF por 30 min. Em seguida, a recuperação do antígeno foi realizada colocando as lâminas em 700ml de tampão de recuperação de antígeno (10mM TrisHCl, EDTA 1 mM, glicerol a 10%, pH 9,0) a 95°C durante 25 min. As lâminas foram então resfriadas à temperatura ambiente por 30 min e enxaguadas com PBS (2X por 2 min) antes de serem bloqueadas em 10% de soro de cavalo, burro ou cabra (dependendo da espécie dos anticorpos secundários) em 0,1% de PBS-T para 1h em temperatura ambiente. As lâminas foram incubadas com anticorpos primários em PBST sérico a 2% durante a noite a 4°C. No dia seguinte, as lâminas foram lavadas em PBS (3X por 10 min) e incubadas com anticorpos secundários por 1 h em temperatura ambiente. Para detecção de fluorescência, anticorpos conjugados com fluoróforo foram usados para coloração secundária.
Coloração de imunofluorescência de seções de tecido cerebral congelado
Tecidos cerebrais isolados foram fixados em paraformaldeído a 4% durante a noite a 4°C, lavados em PBS (2X por 15 min cada) e crioprotegidos em sacarose a 30% por 3 dias ou até os órgãos assentarem no fundo. Os tecidos foram então congelados em composto de temperatura de corte ideal (composto OCT; Fisher Healthcare) a -20°C. Usando um criostato, seções de 16-20 μm foram cortadas, lavadas 3 vezes em PBS por 5 min, permeabilizadas em 0,25% PBS-Tween 20 por 45 min antes de serem bloqueadas em 10% de soro de cavalo em PBST (1X PBS, 0,05% Tween20) para 1h em temperatura ambiente. As seções foram então coradas com anticorpos primários (1:100) durante a noite e lavadas três vezes em PBST por 10 min cada, seguidas por anticorpos secundários (1:500) por 1 h no escuro à temperatura ambiente. As seções foram lavadas três vezes em PBST por 5 min cada e depois coradas com DAPI(1:1.000) e montado com ouro prolongado para imagens confocais .
Sequenciamento de RNA e análise bioinformática
RNA total isolado de células HCC1954 (S-BM, Lat, M-BM) cultivadas em condições R3F. A qualidade do RNA foi verificada com um Agilent BioAnalyzer 2000. O RNA com um número de integridade superior a 9,5 foi usado para análises subsequentes. As bibliotecas foram preparadas com TruSeq RNA Sample Prep Kit v2 (Illumina). As bibliotecas de RNA foram preparadas para sequenciamento usando protocolos padrão da Illumina. Arquivos Fastq com comprimento de leitura de 76 bp de extremidade única foram verificados quanto à qualidade usando fastqc (v0.11.2) e tela fastq (v0.4.4). Os arquivos Fastq foram mapeados para o genoma de referência humano (hg19) usando STAR (v2.5.3a) ( Langmead e Salzberg, 2012). As contagens de leitura foram geradas usando o recurso Contagens (subleitura) para codificar genes de gencode(v19) e igenomas. A análise de expressão diferencial foi realizada usando edgeR. As análises de componentes principais foram geradas usando a ferramenta web Clustvis ( Metsalu e Vilo, 2015 ). A Análise de Enriquecimento do Conjunto de Genes Classificado (GSEA) foi realizada com o software versão 4.0.3. A configuração padrão foi usada, exceto para “Recolher/Remapear conjunto de dados para símbolos de genes” definido como “Sem colapso” e tipo de permutação “Fenótipo” como “Conjunto de genes”.
Quantificação e análise estatística
Os tamanhos das amostras foram pré-determinados de acordo com o requisito da análise estatística. Todos os experimentos de cultura de células incluíram pelo menos três réplicas biológicas e em experimentos com animais cada grupo continha pelo menos 4-15 camundongos. Os pontos de dados individuais foram representados como pontos em gráficos. Os dados apresentaram distribuição normal tanto no teste de D’Agostino-Pearson omnibus quanto no teste de Shapiro-Wilk. A significância estatística entre dois grupos comparativos foi determinada usando o teste t de Student . Para comparações estatísticas entre vários grupos de estudo, foi utilizada ANOVA de uma via, seguida pelo teste de Dunnett ou teste de Turquia. O software GraphPad prism 8 foi usado para todas as análises estatísticas. Os valores são expressos como média ± SEM para grupos de controle e comparativos. Os valores foram considerados estatisticamente significativos de acordo com os valores de p (∗ p < 0,05, ∗∗ p < 0,01, ∗∗∗ p < 0,001, ∗∗∗∗ p < 0,0001 e ns = não significativo).
Agradecimentos
Este trabalho foi apoiado pela bolsa de treinamento CPRIT RP210041 para PKP; NSF concede 2019281049 ao MMP; NCI concede R35CA22044901 a RJD; e CPRIT ( RR170003 ), ACS ( RSG-20-47-01-CSM ) e METAvivor ( GAA202106-0027 ) para SM Agradecemos a assistência da instalação de núcleo de radiação pré-clínica apoiada pelo CPRIT RP180770 para imagens de bioluminescência e Apoio ao Centro de Câncer concessão ( P30 CA142543) para recursos compartilhados de gerenciamento de tecidos e imagens de pequenos animais. Ilustrações criadas com https://biorender.com/ .
Contribuições do autor
Conceituação, PKP e SM; metodologia, PKP, MM-P., VN, AKK e SM; investigação, PKP, MM-P., VN, AKK, KK, JS, EQ-D., AC, VV, CL e SM; redação – rascunho original, SM; redação – revisão e edição, PKP, CLA, ABH, RJD e SM; aquisição de financiamento, SM; recursos, PIG-E., MES, BCM, CL, YP e ABH; supervisão, SM
Declaração de interesses
A ABH recebeu apoio financeiro para pesquisa da Takeda e apoio para viagens da Puma Biotechnology. A CLA recebe ou recebeu apoio de bolsas de pesquisa da Pfizer, Lilly e Takeda; detém opções de ações na Provista e Y-TRAP; e atua ou atuou como consultor da Novartis, Lilly, TAIHO Oncology, Daiichi Sankyo, Merck, AstraZeneca, OrigiMed, Immunomedics e Susan G. Komen Foundation. RJD é fundador da Atavistik Biosciences e consultor da Agios Pharmaceuticals, Nirogy Therapeutics e Vida Ventures.





