O ensaio de perfil genômico abrangente (CGP) é cada vez mais usado em países de renda média baixa para detectar alterações genômicas clinicamente relevantes, apesar de seus benefícios clínicos não serem bem conhecidos. Aqui, descrevemos a proporção de pacientes com câncer avançado na Índia que receberam terapia direcionada para uma alteração genética acionável identificada em ensaios de CGP.
Este foi um estudo de coorte retrospectivo multicêntrico em pacientes adultos com neoplasias malignas não hematológicas avançadas que foram submetidos a um teste de CGP. Se os pacientes receberam uma terapia direcionada por ≥ 6 meses, eles foram considerados como tendo obtido um benefício clínico da medicação, enquanto aqueles que continuaram por ≥ 12 meses foram considerados como tendo uma resposta excepcional. Estatísticas descritivas foram usadas para descrever a proporção de pacientes com terapia direcionada subsequente.
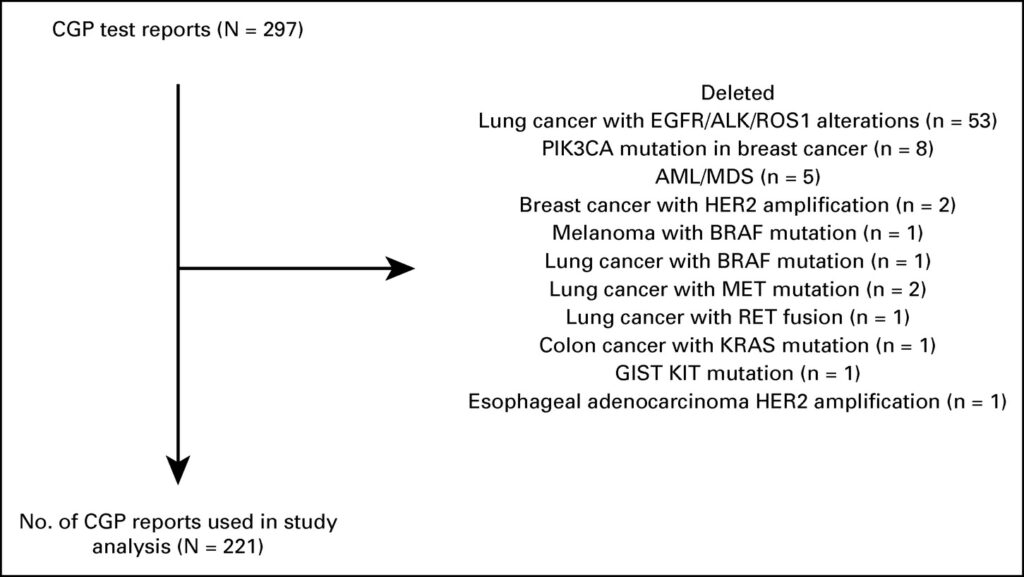
Durante 2019-2020, 12 médicos oncologistas forneceram relatórios de CGP para 297 pacientes; 221 preencheram os critérios de inclusão. Os pacientes receberam uma mediana de duas linhas (intervalo: 0-5) de terapia sistêmica prévia. Com base no ensaio CGP, 21 pacientes (10%) receberam terapia direcionada. Entre eles, 33% foi para amplificação do receptor 2 do fator de crescimento epidérmico humano (HER2) (não câncer de mama) e 19% para HER2 ou mutação de inserção do exon 20 do receptor do fator de crescimento epidérmico (câncer de pulmão). Após excluir pacientes com HER2 ou inserções do exon 20 do receptor do fator de crescimento epidérmico, 8% dos 217 pacientes receberam terapia direcionada. Na coorte geral de 221 pacientes, o benefício clínico foi observado em nove pacientes (4%), dos quais dois foram respondedores excepcionais (1%).
Observamos que em um cenário de país de renda média baixa, 10% dos pacientes receberam terapia direcionada com base no ensaio CGP. Apenas 4% dos pacientes submetidos ao teste de CGP obtiveram benefício clínico.
INTRODUÇÃO
O câncer surge por causa de mutações no genoma humano, resultando no desenvolvimento de células neoplásicas. As técnicas de sequenciamento de próxima geração (NGS) nos fornecem o perfil genético do câncer do paciente, o que auxilia na identificação de alterações genéticas clinicamente relevantes que podem servir como alvos para potenciais terapias. A primeira terapia alvo molecular com base no perfil genético foi o trastuzumab em pacientes com câncer de mama com superexpressão de ERBB2, introduzida em 1998. Desde então, um grande número de novas terapias direcionadas foi descoberto, incluindo inibidores bcr/abl na leucemia mieloide crônica, inibidores BRAF na melanoma, inibidores da tirosina quinase do receptor do fator de crescimento epidérmico (EGFR) no câncer de pulmão de células não pequenas, que produziram respostas terapêuticas robustas. A partir de 2019,
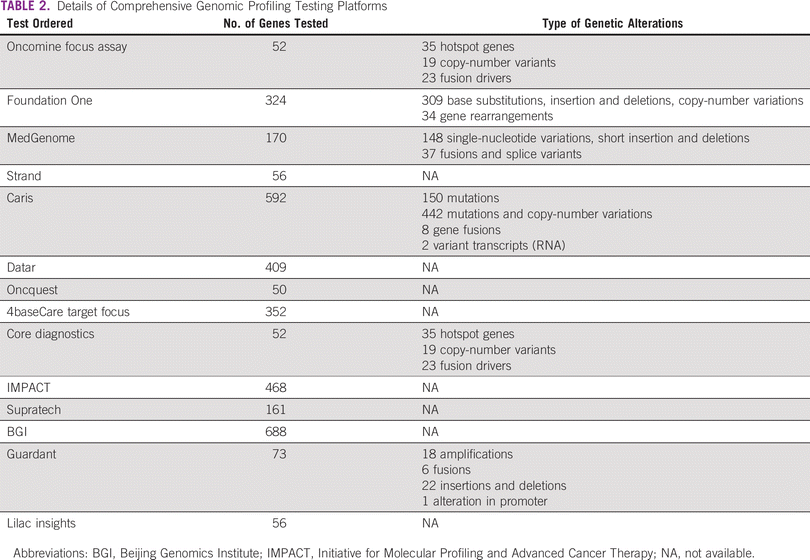
Várias plataformas abrangentes de teste de perfis genômicos (CGP), como MedGenome, Caris e Foundation One, estão atualmente disponíveis, cada uma avaliando diferentes tipos e números de genes. Notável atividade antineoplásica associada a terapias direcionadas levou a um aumento no uso de CGP para detectar alterações genômicas clinicamente relevantes. Embora um grande número de pacientes perfilados tenha alterações genômicas que poderiam ser alvo de terapias moleculares, apenas uma fração muito pequena deles realmente recebe essas terapias direcionadas ao sequenciamento. 1 – 8 Em um estudo recente de Cobain, 80,5% dos pacientes de perfil tinham variações genéticas acionáveis, mas apenas 16,2% receberam terapia direcionada com base no ensaio CGP. 1Entre os pacientes que receberam terapia direcionada, apenas 37,1% (4,82% do total de pacientes perfilados) relataram benefícios clínicos. 1 Resultados semelhantes também foram declarados por outros estudos onde os benefícios clínicos foram observados em apenas 2%-8% do total de pacientes perfilados. 1 , 4 – 6 O estudo SHIVA, o único estudo randomizado que avaliou os benefícios terapêuticos da terapia direcionada com base no ensaio CGP, relatou que o tratamento com terapia molecular combinada não produziu aumento significativo na sobrevida livre de progressão de pacientes com câncer. 9 Em contradição com isso, existem outros estudos não randomizados que relatam resultados clínicos superiores associados a terapias moleculares direcionadas ao sequenciamento. 3, 5 , 8 , 10 – 13
Apesar da disponibilidade e uso clínico do CGP entre pacientes com câncer em países de renda média baixa (PBMRs), há uma escassez de estudos sistêmicos que avaliem sua utilidade clínica. Isso exige mais estudos que avaliem a influência do ensaio CGP nas decisões de tratamento para que seus benefícios terapêuticos possam ser determinados. Em nosso estudo retrospectivo multicêntrico, descrevemos a proporção de pacientes com câncer avançado na Índia que eventualmente receberam terapia molecular direcionada com base no ensaio CGP. Também estimamos o benefício clínico de tal teste e estratégia terapêutica.
LMA, leucemia mielomonocítica aguda;
CGP, perfil genômico abrangente;
EGFR, receptor do fator de crescimento epidérmico;
GIST, tumores estromais GI;
HER2, receptor 2 do fator de crescimento epidérmico humano;
SMD, síndrome mielodisplásica.
Dizia-se que as terapias direcionadas ao sequenciamento eram fornecidas apenas quando o CGP pudesse identificar uma mutação acionável em um paciente para o qual uma terapia off-label ou um ensaio clínico estivesse disponível. Obteve-se a aprovação do Comitê de Ética Institucional. Os dados sobre os pacientes elegíveis foram coletados de 12 oncologistas participantes de diferentes partes do país. Os dados foram coletados entre agosto de 2020 e dezembro de 2021. Os oncologistas forneceram informações anônimas de relatórios consecutivos de exames de CGP, juntamente com as características demográficas do paciente, por meio de um formulário de captura de dados online. Detalhes sobre a demografia do paciente, tipo de biópsia, linhas anteriores de terapia sistêmica, tipo e número de mutações, plataforma CGP usada, terapia direcionada ao genoma recebida e lógica por trás da rejeição de terapias direcionadas ao sequenciamento foram extraídas dos formulários de captura de dados.
A proporção de pacientes com perfil que receberam terapias direcionadas ao sequenciamento e as razões para o declínio das terapias direcionadas foram então avaliadas usando estatísticas descritivas.
O ensaio CGP pode ser realizado em biópsia de tecido e líquido. Tanto o tecido arquivado quanto o tecido fresco foram usados para análise de tecido. A decisão de realizar os ensaios de CGP foi tomada pelo oncologista responsável pelo tratamento. As técnicas de CGP por NGS podem detectar simultaneamente diferentes tipos de alterações genéticas, como inserção, deleção, fusão, amplificação, rearranjo e mutações de genes. Muitas plataformas diferentes, como MedGenome, Foundation One e Oncomine Focus, foram usadas para CGP. Cada uma dessas plataformas avaliou diferentes genes e tipos de alterações genéticas.
O relatório CGP identifica todas as alterações genéticas acionáveis presentes no paciente, juntamente com as possíveis modalidades de tratamento. A intervenção terapêutica com base no ensaio CGP ficou a critério dos oncologistas primários, que poderia ser na forma de administração de um medicamento on-label ou off-label ou inscrição em um ensaio clínico. Se os resultados fossem considerados ineficazes pelo oncologista responsável, outras modalidades de tratamento eram exploradas.
O objetivo primário do estudo foi avaliar a utilidade clínica da NGS determinando a proporção de pacientes com câncer avançado na Índia que eventualmente recebem terapia direcionada para uma alteração genética acionável identificada no ensaio CGP. O objetivo secundário foi determinar o benefício clínico da terapia direcionada ao genoma. Se os pacientes receberam uma terapia direcionada por ≥ 6 meses, eles foram considerados como tendo obtido um benefício clínico da medicação. Pacientes em terapia direcionada por ≥ 12 meses foram considerados como tendo obtido uma resposta excepcional da medicação.
Estatísticas descritivas foram usadas para descrever a proporção de pacientes com terapia direcionada subsequente.
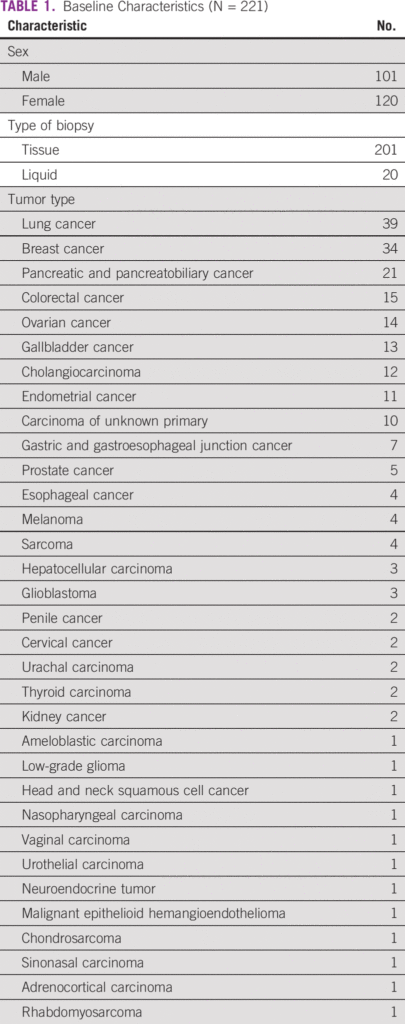
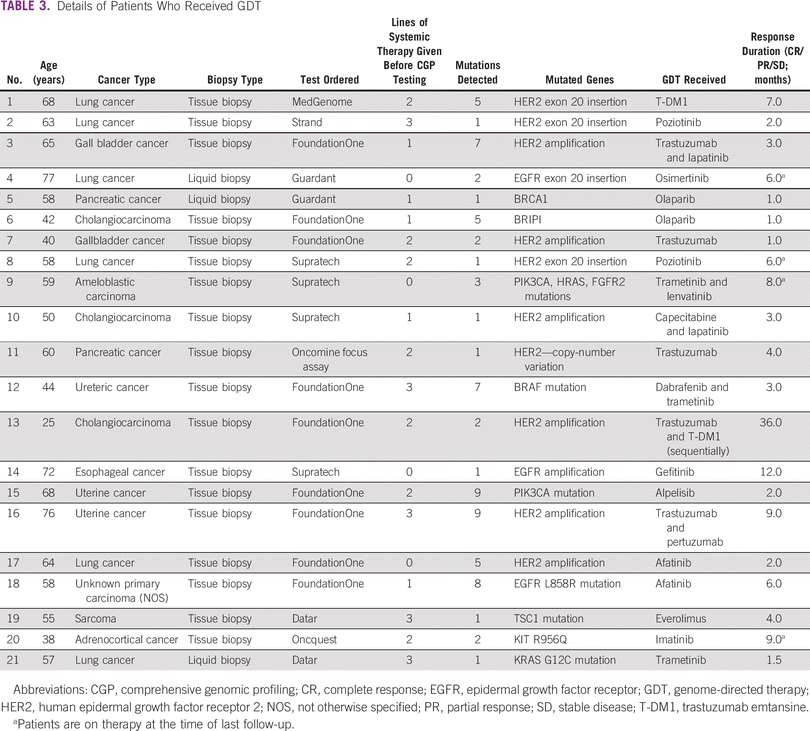
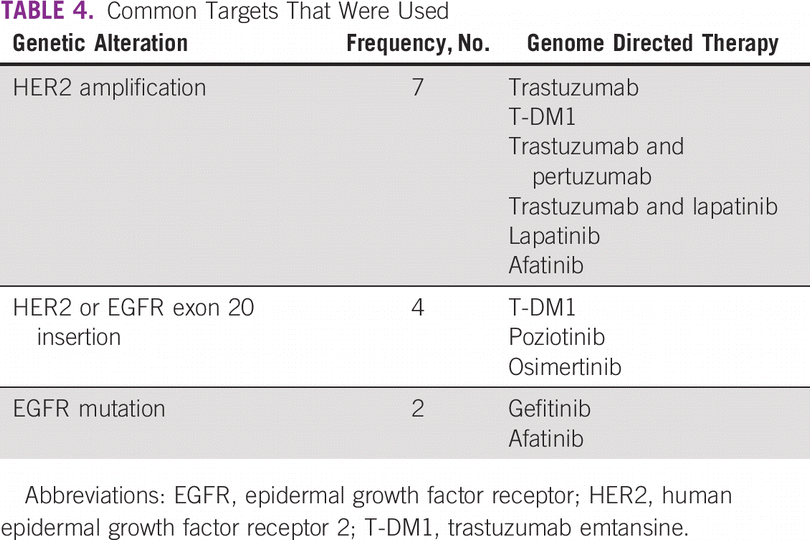
Entre a coorte do estudo, 46% eram do sexo masculino. Noventa e um por cento foram submetidos à biópsia de tecido tumoral e 9% à biópsia líquida. Os cânceres mais comuns foram pulmão (18%), mama (15%), pancreatobiliar (9%) e colorretal (7%). Os pacientes receberam uma mediana de duas linhas (intervalo: 0-5) de terapia sistêmica prévia ( Tabela 1 ). Noventa e seis pacientes (43%) tiveram uma opção de terapia direcionada na forma de um medicamento aprovado ou a disponibilidade de um ensaio clínico de recrutamento global. Com base no ensaio CGP, 21 pacientes (10%) receberam terapia direcionada ( Tabela 3 ). Entre eles, 33% (n = 7) foi para amplificação de HER2 (não câncer de mama) e 19% para mutação de inserção de HER2 ou EGFR exon 20 (câncer de pulmão; n = 4; Tabela 4). A mutação do EGFR foi observada em dois pacientes. Após excluir pacientes com inserção de HER2 ou EGFR exon 20 (quatro pacientes), que são alvos emergentes no câncer de pulmão, 17 pacientes de 217 (8%) receberam terapia direcionada. O motivo mais comum para os pacientes não receberem a terapia direcionada foi a disponibilidade de uma terapia padrão (21%) e o declínio do estado funcional (18%; Tabela 5 ). Na coorte geral de 221 pacientes, o benefício clínico foi observado em nove pacientes (4%), dos quais dois foram respondedores excepcionais (1%). Excluindo os alvos emergentes no câncer de pulmão, o benefício clínico foi observado em seis dos 217 pacientes (3%), dos quais dois foram respondedores excepcionais.

DISCUSSÃO
A medicina personalizada com base na alteração do genoma dos pacientes é uma área de desenvolvimento promissor na terapia do câncer. 14 A substituição de terapias convencionais convencionais não seletivas por drogas genômicas direcionadas adaptadas contra uma mutação específica nas células tumorais é atraente tanto para os médicos quanto para o público em geral. Melhores benefícios clínicos associados a certas terapias direcionadas específicas e a queda no custo do CGP resultaram em uma maior demanda pelos ensaios. Embora existam alguns estudos avaliando a utilidade clínica do CGP na prática regular, os resultados são amplamente contraditórios. 1 , 8 , 9 , 15Até onde sabemos, não há estudos semelhantes realizados em LMICs. Os benefícios clínicos do CGP devem ser adequadamente estudados e devidamente estabelecidos antes que possam ser integrados à prática clínica regular. Isso é especialmente importante em um país em desenvolvimento como a Índia, com um setor de saúde com recursos limitados, onde o CGP ainda permanece excessivamente caro para grandes setores da população.
A NGS é frequentemente prescrita para pacientes quando buscamos uma opção de tratamento na forma de terapia direcionada. Na maioria das vezes, é feito quando os pacientes esgotaram todas as opções terapêuticas padrão de atendimento disponíveis. No entanto, em algumas situações, até mesmo testes iniciais são feitos rotineiramente – por exemplo, para pacientes com adenocarcinoma do pulmão. Também é recomendado no contexto de recrutamento de ensaios clínicos para estudos de novas estratégias de investigação, como terapia direcionada. Neste estudo, nosso objetivo foi avaliar os benefícios do CGP na prática clínica de rotina na Índia. Pacientes com neoplasias de órgãos sólidos submetidos a CGP foram incluídos em nosso estudo. Os pacientes com alterações genéticas que, de outra forma, seriam detectadas com um teste genético direcionado, não foram incluídos na população do estudo – por exemplo,
Dos 221 inscritos em nosso estudo, mutações acionáveis foram encontradas apenas em 96 (43%). Nenhuma mutação ou mutações não acionáveis foram detectadas nos pacientes restantes. Isso é muito menor em comparação com estudos realizados em outros lugares, onde a proporção de alteração genômica clinicamente relevante foi superior a 80%. 1 , 16 , 17 No entanto, a proporção de pacientes que eventualmente receberam terapias direcionadas ao sequenciamento com base em uma alteração genética acionável identificada pelo ensaio CGP foi de 10%. Isso é comparável a estudos semelhantes de outras partes do mundo. 1 , 16 – 18O benefício clínico, definido como uso do medicamento por ≥ 6 meses, foi observado em apenas 4% dos pacientes. Embora o escopo das terapias de precisão continue sendo imenso, o paciente precisa estar ciente da realidade clínica de que apenas uma pequena fração dos pacientes que se submetem a CGP recebe terapias direcionadas ao sequenciamento e uma fração ainda menor realmente se beneficia com isso. 1 O conhecimento desses dados ajudaria no aconselhamento do paciente para que as expectativas correspondam ao cenário do mundo real. A comunicação eficaz entre o paciente e seu oncologista ajudaria a conter as expectativas exageradas associadas à terapia de precisão.
A alteração genômica clinicamente relevante relatada pelas plataformas de CGP pode ser uma mutação com tratamento direcionado bem validado ou um alvo hipotético clinicamente não comprovado contra o qual uma terapia potencial pode ser bem-sucedida. 19 Muitas das plataformas de CGP não priorizam as várias mutações alvo descobertas e muitas vezes cabe ao oncologista selecionar a terapia alvo baseada em evidências clinicamente eficiente. 19 O uso de classificação baseada em valor clínico de mutação acionável semelhante à Escala da Sociedade Europeia de Oncologia Médica para Ação Clínica de Alvos Moleculares permitiria ao oncologista selecionar mutações acionáveis com benefícios clínicos comprovados. 19Alguns alvos altamente recomendados na European Society for Medical Oncology Scale for Clinical Actionability of molecular Targets incluem HER2 no câncer de mama e rearranjos ROS1. 19
CGP na prática clínica deve ser usado com o máximo cuidado. Somos de opinião que o uso imprudente e indiscriminado de CGP seria de valor clínico limitado. Além das indicações padrão, a NGS deve ser restrita a populações de pacientes em situações clínicas específicas. Pode ser prescrito em pacientes com opções terapêuticas limitadas, onde as terapias direcionadas ao sequenciamento podem ajudar na inscrição em um ensaio clínico ou no recebimento de uma terapia off-label. 20 A utilidade clínica do perfil genômico não é uniforme em todos os cânceres. É especialmente útil no câncer de pulmão de células não pequenas, que muitas vezes apresenta várias alterações genômicas que podem ser direcionadas na terapia inicial. 20Cânceres raros sem diretrizes de tratamento bem definidas ou regimes de medicamentos padrão são outra indicação aceita para NGS. 20 No entanto, deve ser evitado em pacientes terminais com câncer agressivo e naqueles com mau estado funcional. 1 , 20 Também não deve ser solicitado em cânceres contra os quais já estão disponíveis terapias convencionais convencionais com valor clínico comprovado ou naqueles casos em que é improvável que o sequenciamento genômico detecte uma nova mutação genômica alvo ou tenha qualquer influência substancial no manejo terapêutico. 1 , 20
O aspecto financeiro do NGS também deve ser levado em perspectiva. Embora seja considerado uma alternativa mais barata aos testes de um único gene, continua inacessível para um grande número de pacientes com câncer na Índia. 21 Além do custo do sequenciamento, o ônus econômico resultante da terapia direcionada que se segue também deve ser levado em consideração ao determinar o custo-benefício da NGS. O impacto econômico da terapia de precisão aumentou a importância em um país como a Índia, com recursos limitados, baixa cobertura de seguro e altos gastos diretos. Também pode haver toxicidades físicas, especialmente quando são usadas terapias combinadas sem dados prévios.
A medicina de precisão tem potencial para revolucionar a oncologia nos próximos anos. O perfil genômico foi fundamental para melhorar nossa compreensão de muitos dos cânceres avançados. Ele nos forneceu uma ampla variedade de opções terapêuticas para cânceres considerados em grande parte intratáveis. Devemos agora nos concentrar na implementação racional da medicina de precisão na prática clínica de rotina. Incentivamos a integração do CGP na prática clínica de rotina, especialmente quando é acessível. No entanto, devemos ser capazes de estimar o valor real do ensaio. Até onde sabemos, este é o primeiro estudo de um contexto LMIC que contextualiza a utilidade do ensaio em um cenário de prática clínica. A criação de placas de tumor molecular é outra medida de implementação que pode aprimorar a ciência da medicina de precisão do laboratório à clínica. Isso ajudaria os oncologistas a escolher opções terapêuticas com o benefício clínico significativo. Um maior acesso a ensaios clínicos aumentaria nossa capacidade de traduzir os resultados do perfil genômico para a prática clínica.
Nosso estudo tem algumas limitações. Primeiro, é um estudo de coorte retrospectivo e pode estar sujeito a viés de memória. No entanto, por ser um estudo multicêntrico, nossos resultados podem ser considerados mais generalizáveis e válidos. A decisão de realizar CGP foi tomada a critério do oncologista primário e não por conselhos de tumor institucional. Portanto, o processo de tomada de decisão pode estar sujeito ao viés individual do médico. Comparar os resultados do nosso estudo com os resultados da tomada de decisão baseada no tumor molecular será um passo importante para testar o impacto de tais esforços colaborativos. Houve também heterogeneidade em relação ao momento do teste CGP. O número de linhas de terapia sistêmica recebidas antes do CGP variou entre 0 e 5. O pequeno tamanho da amostra e a diversidade nos tipos de tumor são outras limitações importantes.
Em conclusão, em nosso estudo, nosso objetivo foi analisar o valor clínico do teste de CGP via NGS na prática clínica de rotina na Índia. Dos 221 pacientes sequenciados, apenas 21 pacientes (10%) receberam terapias direcionadas ao sequenciamento. Apenas 4% obtiveram algum benefício clínico com o teste CGP. As evidências sintetizadas neste estudo podem ajudar no desenvolvimento de intervenções clínicas destinadas a melhorar a prática da medicina de precisão na Índia.
© 2022 pela Sociedade Americana de Oncologia Clínica





