O cabozantinib, um inibidor oral da tirosina quinase contra o MET e o receptor 2 do fator de crescimento endotelial vascular (VEGFR2), é um agente que foi inicialmente recebido com enorme entusiasmo pela comunidade do câncer de próstata. Os dados iniciais mostraram respostas dramáticas à cintilografia óssea, onde as metástases ósseas desapareceriam quase magicamente após o tratamento com cabozantinibe em cintilografias ósseas subsequentes. Como este era um fenômeno desconhecido, mas bem-vindo, a área começou a trabalhar avidamente no desenvolvimento desse agente.
A publicação inicial com cabozantinib foi relatada em um estudo de Fase II randomizado de descontinuação e coorte de expansão. 1 Pacientes (n = 171) com câncer de próstata metastático resistente à castração (mCRPC) foram tratados com cabozantinibe 100 mg PO QD e aqueles com doença estável por RECIST em 12 semanas foram aleatoriamente designados para cabozantinib ou placebo. A atividade observada de cabozantinib levou à interrupção precoce da randomização. No entanto, isso ocorreu devido a 68% dos pacientes terem melhorado a aparência na cintilografia óssea e 72% dos pacientes com doença mensurável terem algum nível de regressão. Por fim, 31 pacientes com doença estável na semana 12 foram randomizados com sobrevida livre de progressão mediana (PFS) de 23,9 vs. 5,9 semanas para os braços de cabozantinibe vs. placebo (razão de risco [HR] 0,12, p <0,001), respectivamente. Uma revisão retrospectiva identificou a melhora da dor óssea em 67% dos pacientes avaliados com uma diminuição no uso de narcóticos em 56%.
Um segundo estudo de Fase II avaliou a dosagem de cabozantinibe 100 mg (n = 93) ou 40 mg (n = 51) PO QD em uma população restrita de câncer de próstata metastático resistente à castração pós-quimioterapia. 2 As respostas à cintilografia óssea foram observadas em 73% e 45 % de pacientes, respectivamente; reduções na doença mensurável foram observadas em 80% e 79% dos pacientes, respectivamente. A PFS mediana foi de 10,8 meses para toda a população. Em relação à dor, 57% dos pacientes experimentaram uma melhora clinicamente significativa na dor, enquanto 55% tiveram uma redução ou descontinuação completa de analgésicos narcóticos.3 A dose de 40 mg PO QD exigiu menos reduções de dose para toxicidade.
Os resultados promissores da Fase II acima levaram ao desenvolvimento do estudo randomizado de Fase III que, infelizmente, não foi capaz de demonstrar um benefício de sobrevida global com cabozantinib no estudo COMET-1. Especificamente, 1.028 homens com mCRPC progressivo após prévio docetaxel e abiraterona e/ou enzalutamida foram randomizados 2:1 para cabozantinibe 60 mg PO QD ou prednisona 5 mg PO BID. Embora a PFS radiográfica tenha sido de 5,6 vs. 2,8 meses (HR 0,48, p<0,001) a favor do cabozantinib em relação à prednisona, respectivamente, a sobrevida global foi o desfecho primário. A sobrevida global mediana foi de 11,0 vs. 9,8 meses (HR 0,90, p=0,213), sem significância estatística, com cabozantinib vs. prednisona, respectivamente.
Os resultados negativos do COMET-1, infelizmente, levaram ao término antecipado do estudo randomizado de Fase III COMET-2. O estudo COMET-2 randomizou homens com mCRPC ósseo doloroso no estado pós-docetaxel e pós abiraterona ou enzalutamida para cabozantinibe 60 mg PO QD vs mitoxantrona 12 mg/m2 IV a cada três semanas mais prednisona 5 mg PO BID. O desfecho primário foi a resposta à dor em seis semanas com confirmação na semana 12 com o objetivo de > 30% diminuir a dor desde a linha de base por meio do Inventário Breve de Dor sem aumento do uso de narcóticos. No encerramento do estudo, 119 pacientes foram randomizados. Com apenas 69% dos pacientes avaliáveis para o desfecho de resposta à dor de 12 semanas, não houve diferença significativa entre os dois braços, com 15% vs. 17% (p=0,8) para cabozantinibe vs. mitoxantrona com prednisona, respectivamente.4
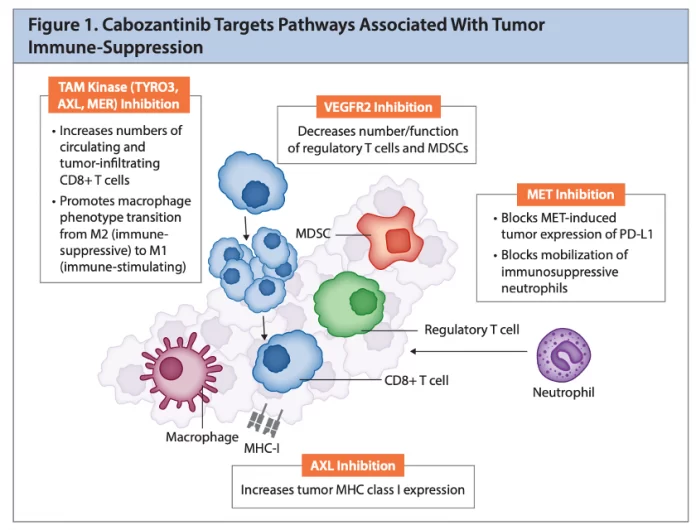
Embora o cabozantinib tenha tido sucesso em outras malignidades com aprovações da Federal Drug Administration (FDA) dos Estados Unidos em carcinoma de células renais,5 carcinoma hepatocelular5 e câncer medular de tireoide,6 o entusiasmo pelo uso de agente único no câncer de próstata foi perdido após a experiência acima. No entanto, ficou claro que havia atividade antitumoral. Portanto, era razoável testar uma nova terapia de combinação. Recentemente, o estudo da cesta COSMIC-021 combinou cabozantinibe com atezolizumabe, testando o conceito de que o cabozantinibe pode promover um microambiente imunopermissivo. É possível que os linfócitos infiltrantes de tumor (TILs) possam aumentar após o tratamento com cabozantinib. A Coorte 6 tratou 44 pacientes com mCRPC que tiveram progressão radiográfica com doença mensurável após abiraterona e/ou enzalutamida anteriores. 6 O desfecho primário da taxa de resposta geral do RECIST 1.1 foi alcançado por 32% dos pacientes. Fadiga (50%), náusea (43%), diminuição do apetite (39%), diarreia (39%), disgeusia (34%) e eritrodisestesia palmo-plantar (32%) foram os eventos adversos mais comuns relacionados ao tratamento.
Como resultado dos dados COSMIC-021 acima, um estudo randomizado de Fase III de cabozantinib versus um segundo novo agente de terapia hormonal foi lançado e é denominado estudo CONTACT-02 (NCT04446117). No entanto, outras combinações com inibidores de checkpoint estão sendo estudados
Highlighted trials with Cabozantinib for prostate cancer patients
COPYRIGHT © 2002 – 2022 DIGITAL SCIENCE PRESS, LLC
Login to update email address, newsletter preferences and use bookmarks.